Asimetrični ogljik
- 2243
- 130
- Percy Feeney
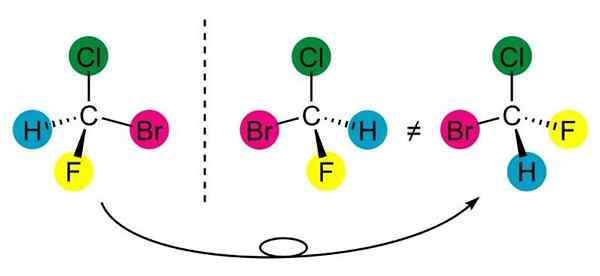
 Bromoklorofluorometan, primer asimetričnega ogljika ali kiralne molekule. Vir: Calvero., Wikimedia Commons
Bromoklorofluorometan, primer asimetričnega ogljika ali kiralne molekule. Vir: Calvero., Wikimedia Commons Kaj je asimetrični ogljik?
A asimetrični ogljik To je ogljikov atom, ki je povezan s štirimi različnimi kemičnimi elementi drug od drugega. V tej strukturi je v središču ogljikov atom in skozi njega povezuje preostale elemente.
Molekula Bromochloroyodometana je jasen primer asimetričnega ogljika. V tem primeru je atom ogljika povezan z atomi broma, klora, joda in vodika z edinstvenimi vezmi.
Ta vrsta formacij je zelo pogosta v organskih spojinah, kot je gliceraldehid, preprost sladkor, ki ga dobimo kot produkt procesa fotosinteze v rastlinah.
Značilnosti asimetričnega ogljika
- Asimetrični ogljikovi ogljiki so tetraedrski ogljiki, ki so med seboj povezani s štirimi različnimi elementi.
- Ta konfiguracija je podobna zvezdi: asimetrični ogljik deluje kot jedro strukture, preostali del komponent.
- Dejstvo, da se elementi med seboj ne ponavljajo, daje tej tvorbi konotacijo asimetričnega ali kiralnega.
- Vsak element mora biti pritrjen na asimetrični ogljik skozi eno povezavo. Če bi bil element vezan na ogljik z dvojno ali trojno vezjo, potem ogljik ne bi bil več asimetričen.
- Če se asimetrična struktura dvakrat pridruži atomu ogljika, slednji ne bi mogel biti asimetričen.
- Če ima v kemični spojini dva ali več asimetričnih ogljikov, se povzroči prisotnost qillarityja v celotni strukturi.
Quillarity je tista lastnost, ki se ne prekriva s sliko, ki se odraža v ogledalu. To pomeni, da sta obe sliki (resnični objekt v primerjavi z odsevom) asimetrični drug od drugega.
Vam lahko služi: molekularni kisik: struktura, lastnosti, uporabePosledično, če imate nekaj struktur z asimetričnimi ogljikovimi in vsaka njena elementa sta enaka, se obe strukturi ne moreta prekrivati.
Poleg tega se vsaka struktura imenuje enantiomer ali optični izomer. Te strukture imajo enake fizikalne in kemijske lastnosti, razlikujejo se le v svoji optični aktivnosti, to je odziv, ki ga predstavljajo na polarizirano svetlobo.
Primeri asimetričnih ogljikov
Ta vrsta struktur je običajna v naslednjih organskih spojinah:
- Ogljikovi hidrati.
- Etilne skupine, na primer v strukturi -ch2ch3, -oh, -ch2ch2ch3, -ch3 in -ch2nh3.
- V drogah so prisotni tudi asimetrični ogljiki, prav tako pri psevdoefedrina (c10HpetnajstNe), zdravilo, ki se uporablja pri zdravljenju nosne zastoje in pritiska v sinusih.
- 2-klorobutano.
- Butan-2-OC.
Reference
- Asimetrični ogljik, srioisomer in epimer. Pridobljeno s fakultete.UNE.Edu.
- Asimetrični ogljik. Okreval od Es.Wikipedija.org.

