Oblikovanje karbokacije, značilnosti, vrste, stabilnost
- 3357
- 234
- Roman Schamberger
A karbokacija, Kot že ime pove, je organski ion, ki ima pozitivno naložen ogljikov atom, za katerega je značilno, da je zelo nestabilen, za kratek čas obstaja. Običajno je posrednik v organskih reakcijah, to pomeni, da izvira kot nepogrešljivi koraki ustreznih molekulskih mehanizmov.
Zgodovinsko so bile konfliktne točke pri stiskanju, kaj je karbokacija. To je zato, ker obstajajo simfini reaktivnih molekul, ki iz takšnih ali drugačnih razlogov pridobijo pozitivno obremenitev v enem od svojih ogljikov. Klasična karbokacija, tako rekoč, je tista, ki jo lahko predstavlja splošna formula spodnje slike.
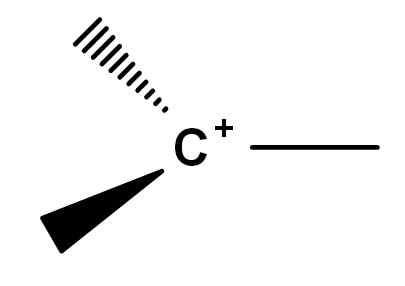 Splošna formula karbokacije. Vir: Gabriel Bolívar.
Splošna formula karbokacije. Vir: Gabriel Bolívar. Upoštevajte, kako se pozitivna obremenitev nahaja točno na ogljikovem atomu, prav tako pa nima povezave. Zato je karbokacija slaba elektrona, kar je vzrok njegove visoke reaktivnosti.
Recimo Metan, Cho4. Če bi Carbon izgubil enega od svojih vodikovih atomov, bi odpravili eno od štirih C-H vezi. Potem je nastala metilna karbokacija, ch3+, kar bi lahko predstavljali samo tako, da postavimo atome vodika na koncih trakov zgornje formule. Pogl3+ Je najpreprostejši od vseh karbokacij.
[TOC]
Usposabljanje
Kako se tvorijo karbokacije? Odgovor najdemo v mehanizmih reakcij. Vendar pa velika večina skupnih delnic enega od naslednjih dveh vidikov:
-Heterolitična ruptura
-Dodajanje elektronov π v elektrofil
Heterolitična ruptura
V heterolitski rupturi je C-G vez, G, ki je kateri koli atom ali skupina, neenakomerno pokvari: elektroni vezi ostanejo g, medtem ko ogljikov atom pridobi pozitivno obremenitev. Na primer:
Vam lahko služi: arzen: zgodovina, struktura, lastnosti, uporabe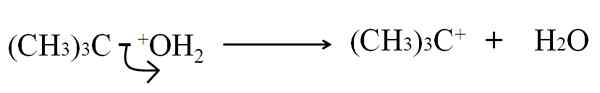 Heterolitična ruptura v dehidraciji terbutanola. Vir: Gabriel Bolívar.
Heterolitična ruptura v dehidraciji terbutanola. Vir: Gabriel Bolívar. Zdaj je ta prelom mogoče dati za več metod, kar bo spremenilo mehanizem in reakcijo.
Dodajanje elektronov π v elektrofil
Drugi postopek, s katerim se oblikuje karbokacija, ki je zelo pogost v aromatičnih alkenih in spojinah, je z napadom na elektrone dvojne vezi na elektrofil. Najpogostejši primeri so hidrogenacija alkenov z delovanjem kisline:
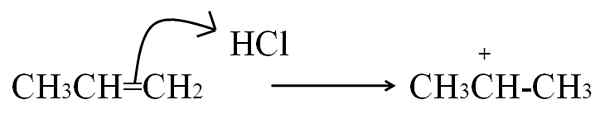 HCL reakcija s propenom, da tvori karbokacijo kot posrednik. Vir: Gabriel Bolívar.
HCL reakcija s propenom, da tvori karbokacijo kot posrednik. Vir: Gabriel Bolívar. Ta enačba ustreza tvorbi karbokacije, ki je Posrednik, Ne izdelek. Elektroni z dvojnim vezanjem napadajo HCl Hydrogen, elektrofil. Vodik se doda ogljiku na desni strani dvojne vezi, tako da se skupina -CH oblikuje3, Medtem ko ogljik na levi strani pridobi pozitivno obremenitev.
Značilnosti
Hibridizacija
Splošna formula, predstavljena na začetku, razkriva trigonalno ravno geometrijo okoli ogljikovega atoma. To je posledica hibridizacije, ki jo utrpijo ogljikove atomske orbitale, da postanejo hibridne sp orbitale2, ki so ločeni pod kotom 120 °. Čeprav ni predstavljen, ima karbokacija orbital str Čist in prazen, sposoben sprejeti elektrone.
Kislost
Karbokacija je kisla vrsta, bodisi v skladu z definicijo Brönsteda ali Lewisa. Njihovi pozitivni naboj Elektroni ali vodikovi atomi, ki so podani. Iz tega razloga karbokacij ni mogoče oblikovati v zelo osnovnih medijih, saj bi takoj reagirali na nastanek drugih izdelkov.
Stabilnost
Hibridizacija sp2 karbokacije je ranljiv za napade bogatih vrst v elektroni. Ta značilnost je še poudarjena z veliko kislostjo. Posledično je karbokacija zelo reaktivna vrsta, ki se skoraj ne oblikuje in kmalu (v nekaj nanosekund) reagira, da povzroči resnični produkt kemijske reakcije.
Vam lahko služi: sulfamična kislina: struktura, lastnosti, sinteza, uporabaVrste karbokacij
Obstaja več vrst karbokacij. Vendar jih je mogoče razvrstiti na naslednji način:
-Primarno
-Sekundarna
-Terciar
-Aromatični ali arillos
-Vinil in alilic
Primarno
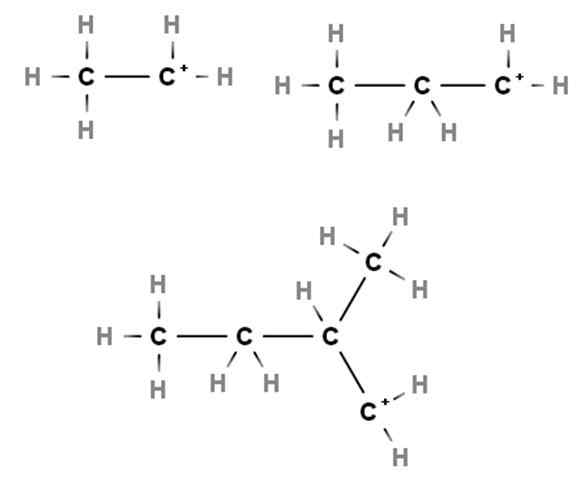 Primarne karbokacije. Vir: Gabriel Bolívar prek Molview.
Primarne karbokacije. Vir: Gabriel Bolívar prek Molview. Prihodi prikazujejo primere primarnih karbokacij. To se imenujejo, ker je pozitivna obremenitev v primarnem ogljiku, 1., zato je povezana le z ogljikovim atomom. Etano, pogl3Pogl3, Ko h izgubi kateri koli od svojih koncev, karbokacija cho3Pogl2+ tudi +Pogl2Pogl3.
Sekundarna
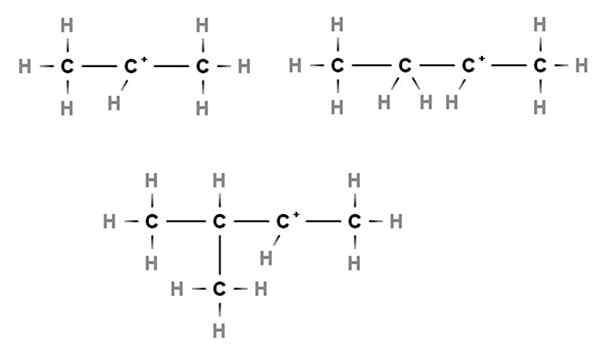 Sekundarne karbokacije. Vir: Gabriel Bolívar prek Molview.
Sekundarne karbokacije. Vir: Gabriel Bolívar prek Molview. Pri sekundarnih karbokacijah je pozitivna obremenitev nameščena v sekundarnem ogljiku, 2., ki je povezan z dvema atoma ogljika. Na primer, če je propan, cho3Pogl2Pogl3, Odvzamemo h osrednjega ogljika, imeli bomo karbokacijo3Pogl2+Pogl3.
Terciar
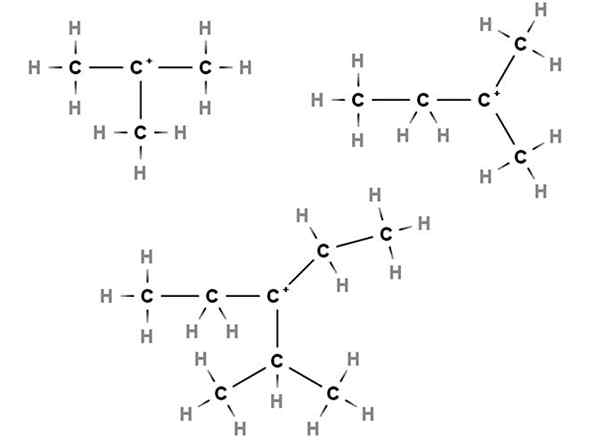 Terciarne karbokacije. Vir: Gabriel Bolívar prek Molview.
Terciarne karbokacije. Vir: Gabriel Bolívar prek Molview. V terciarnih karbokacijah je pozitivna obremenitev nameščena v terciarnem ogljiku, 3. Upoštevajte, da za razliko od prvih dveh vrst karbokacij nimajo atomov vodika.
Tako imamo metilpropane ali izobutane, ch (ch (izberite3)3, Ki z izgubo vodika osrednji ogljik tvori karbokacijo +C (pogl3)3.
Aromatična
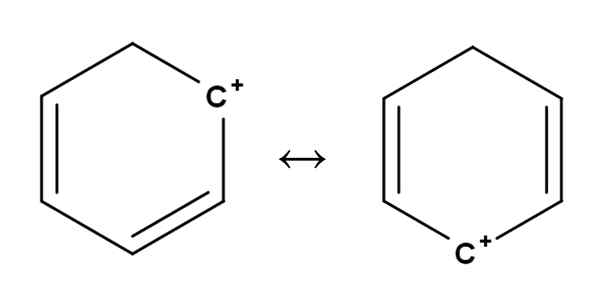 Benzene karbokat. Vir: Gabriel Bolívar.
Benzene karbokat. Vir: Gabriel Bolívar. Aromatične ali aromatične karbokacije so morda najbolj posebne od vseh. Vaše usposabljanje je zelo podobno tistemu, ki je opisano za Alkene v prvem razdelku.
V njih je pozitivna obremenitev načeloma v enem od ogljikov aromatičnega obroča, kot je benzen. Vendar pozitivna obremenitev ni določena, ampak se z resonanco razprši v drugih položajih obroča.
Lahko vam služi: ribulosa-1,5-bifosfat (rubp): značilnosti, karboliksacijaTako pozitivna obremenitev, kot je razvidno zgoraj, prehaja iz enega ogljika v drugega znotraj benzenskega obroča. Ta značilnost daje tej karbokaciji veliko stabilnost proti drugim vrstam karbokacij.
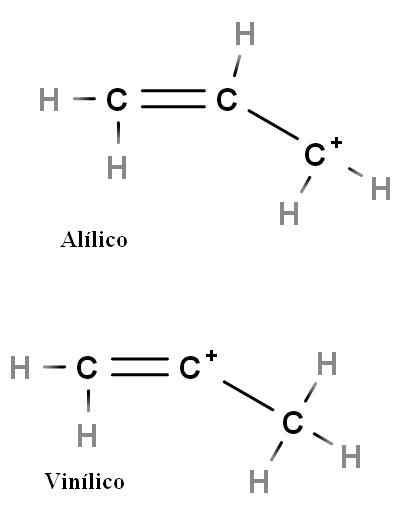
Alilski in vinil
 Alilska in vinilna karbokacija. Vir: Gabriel Bolívar.
Alilska in vinilna karbokacija. Vir: Gabriel Bolívar. Druge posebne vrste karbokacij so alilične in vinil. Razlika med njimi (zgoraj) je položaj pozitivnega naboja, povezanega z dvojno vezjo.
Pri vinilni karbokaciji pozitivna obremenitev najdemo v enem od ogljikovih dvojnih vezi; Medtem ko je v alialni karbokaciji, je pozitivna obremenitev nameščena v ogljiku po dvojni vezi. Dovolj je, da zamenjamo vodike z drugimi skupinami in imeli bomo ogromno družine ali vinilnih karbokacij.
Relativna stabilnost
Če veste, katere so glavne vrste karbokacij, jih je mogoče naročiti na podlagi njihove relativne stabilnosti:
Vinil < Primario < Secundario < Alílico < Terciario < Aromático
Zdaj so morda na voljo karbokacije, ki so bolj stabilne kot določena terciarna. Vse bo odvisno od njihovih substituentov.
Zakaj ta stabilnost? Sposobnost molekule, da se razprši ali zmanjša pozitivno obremenitev karbokacije. Če želite to narediti. Medtem v alumičnih in aromatičnih karbokacijah to dosežemo z resonanco.
V primeru vinilne karbokacije je pozitivna obremenitev nameščena na ogljiku, ki je bil že sp2, zaradi česar je zelo nestabilno.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Karbokacija. Pridobljeno iz: v.Wikipedija.org
- James Ashenhurst. (20. februar 2020). 3 dejavniki, ki stabilizirajo karbokacije. Okrevano od: mastersorganicChemistry.com
- Clark Jim. (2000). Karbokacije (ali karbonske ione). Okrevano od: Chemguide.co.Združeno kraljestvo
- Doktor. Kennepohl, prof. S. Kmet & t. Soderberg. (10. avgust 2020). Struktura karbokacije in stabilnost. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Koncept, značilnosti in primeri okoljskih etičnih kod
- 4 postaje leta v Mehiki in njegove značilnosti »

