Reakcijska toplota
- 1017
- 175
- Cary Goyette
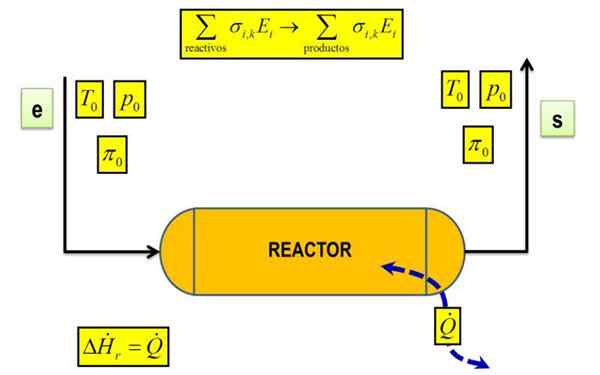
 Shema reakcijske toplote v določenih temperaturnih in tlačnih pogojih. Vir: Joseasorrentino, CC BY-SA 4.0, Wikimedia Commons
Shema reakcijske toplote v določenih temperaturnih in tlačnih pogojih. Vir: Joseasorrentino, CC BY-SA 4.0, Wikimedia Commons Kaj je reakcijska toplota?
On reakcijska toplota, o Entalpija reakcije (ΔH) je količina energije na krt, ki se sprosti ali proizvaja v kemični reakciji s konstantnim tlakom. To je termodinamična enota uporabnega ukrepa za izračun ali proizvedeno energijo.
Ker entalpija izhaja iz tlaka, volumna in notranje energije, ki so vse državne funkcije, je entalpija tudi stavna funkcija.
ΔH ali sprememba entalpije se je pojavila kot merilna enota, ki je bila usmerjena v izračun spremembe energije sistema, ko je postalo pretežko najti ΔU ali spremeniti notranjo energijo sistema, hkrati meril količino toplote in izmenjano delo.
Daj.
Zapis ΔHº ali ΔHºr nato se pojavi, da razložite natančno temperaturo in tlak reakcijske toplote ΔH.
Standardna reakcijska entalpija simbolizira ΔHº ali ΔHºrxn in lahko prevzame tako pozitivne kot negativne vrednosti. Enote za ΔHº so kilojulios na mol ali kJ / mol.
Predhodni koncept za razumevanje reakcijske toplote: razlike med ΔH in ΔHºr
- Δ = predstavlja spremembo entalpije (entalpija produktov, razen entalpije reaktantov).
Pozitivna vrednost kaže, da imajo produkti večjo entalpijo ali da gre za endotermično reakcijo (potrebna je toplota).
Negativna vrednost kaže, da imajo reaktanti večjo entalpijo ali da gre za eksotermično reakcijo (toplota).
- º = pomeni, da je reakcija standardna sprememba entalpije in se pojavi pri vnaprej ustaljenem tlaku / temperaturi.
- R = označuje, da je ta sprememba entalpija reakcije.
Vam lahko služi: kalcij: lastnosti, struktura, pridobi, uporabi- Standardno stanje: Standardno stanje trdne ali tekočine je čista snov pri tlaku 1 bar ali kaj je enako, 1 atmosfero (105 Pa) in temperatura 25 ° C ali kaj je enaka, 298 k.
- ΔHºr Gre za standardno toploto reakcije ali standardne entalpije reakcije, in ker ΔH meri tudi entalpijo reakcije. Vendar ΔHºrxn poteka v „standardnih“ pogojih, kar pomeni, da reakcija poteka pri 25 ° C in 1 atm.
Prednost merjenja ΔH v standardnih pogojih je v zmožnosti povezovanja vrednosti ΔHº z drugim, saj se pojavljajo v enakih pogojih.
Trdilna toplota
Standardna tvorba toplota, ΔHFº, kemikalije je količina, ki se absorbira ali sprosti iz tvorbe 1 mol te kemikalije pri 25 ° C in 1 bar njegovih elementov v svojih standardnih stanjih.
Element je v standardnem stanju, če je v najbolj stabilni obliki in fizičnem stanju (trdna, tekočina ali plin) pri 25 ° C in 1 bar.
Na primer, standardna toplota nastanka za ogljikov dioksid pomeni kisik in ogljik kot reagente.
Kisik je bolj stabilen kot molekule plina oz2, Medtem ko je ogljik bolj stabilen kot trden grafit (grafit je v standardnih pogojih bolj stabilen kot diamant).
Za izražanje definicije na drug način je standardna toplota tvorbe posebna vrsta standardne reakcijske toplote.
Reakcija je tvorba 1 mol kemikalije njegovih elementov v svojih standardnih stanjih v standardnih pogojih.
Vam lahko služi: kovinski značajStandardna toplota tvorbe se imenuje tudi standardna entalpija tvorbe (čeprav res gre za spremembo entalpije).
Po definiciji tvorba samega samega samega sebe ne bi povzročila spremembe entalpije, zato je standardna reakcijska toplota za vse elemente nič.
Izračun reakcijske entalpije
1. Eksperimentalni izračun
Entalpijo lahko eksperimentalno merimo s kalorimetrom. Kalorimeter je instrument, pri katerem se vzorec reagira prek električnih kablov, ki zagotavljajo aktivacijsko energijo. Vzorec najdemo v posodi, obdani z vodo, ki je nenehno vznemirjena.
Pri merjenju s kalorimetrom se temperaturna sprememba, ki se pojavi, ko vzorec reagira, in poznavanje specifične toplote vode in njegove mase se toplota, ki sprošča ali absorbira reakcijo.
V tej enačbi, kaj je toplota, je CESP specifična toplota, v tem primeru vode, ki je enaka 1 kaloriji na gram, m je masa vode in Δt je sprememba temperature.
Kalorimeter je izoliran sistem, ki ima stalen tlak, torej ΔHr= q
2. Teoretični izračun
Sprememba entalpije ni odvisna od določene poti reakcije, ampak le od ravni globalne energije izdelkov in reagentov. Entalpía je funkcija države in je kot taka aditivna.
Za izračun standardne entalpije reakcije lahko dodamo standardne entalpije tvorbe reagentov in jo odštejemo od vsote standardnih entalpija. Matematično nam to daje:
Lahko vam služi: 6 naravnih kazalnikov pH in njihove značilnostiΔHr° = σ ΔHFº (produkti) - σ ΔHFº (reaktanti).
Reakcije entalpije se običajno izračunajo iz entalpije reagenta v normalnih pogojih (1 barov tlak in temperatura 25 ° C).
Da bi razložili to načelo termodinamike, bomo izračunali entalpijo reakcije za zgorevanje metana (ch4) V skladu s formulo:
Pogl4 (g) + 22 (g) → co₂ (g) + 2h2O (g)
Za izračun standardne reakcijske entalpije moramo iskati standardne entalpije treninga za vsakega reagenta in izdelke, ki sodelujejo v reakciji.
Te so običajno v dodatku ali v več spletnih tabelah. Za to reakcijo so podatki, ki jih potrebujemo,:
HFPogl4 (g) = -75 kjoul/mol.
HFº O2 (g) = 0 kjoul/mol.
HFº co₂ (g) = -394 kjoul/mol.
HFº H₂o (g) = -284 kjoul/mol.
Upoštevajte, da ker je v standardnem stanju, je standardna entalpija tvorbe plina 0 kJ / mol.
Nato povzamemo naše standardne entalpije. Upoštevajte, da moramo, ker so enote v KJ / mol, pomnožiti s stehiometričnimi koeficienti v uravnoteženi reakcijski enačbi.
Σ ΔHFº (izdelki) = ΔHFº co₂ +2 ΔHFº H₂o
Σ ΔHFº (izdelki) = -1 (394 kjoul/mol) -2 (284 kjoul/mol) = -962 kjoul/mol
Σ ΔHFº (reaktanti) = ΔHFPogl4 + ΔHFº O2
Σ ΔHFº (reaktanti) = -75 kjoul/mol + 2 (0 kjoul/mol) = -75 kjoul/mol
Zdaj lahko najdemo standardno entalpijo reakcije:
ΔHr° = σ ΔHFº (produkti) - σ ΔHFº (reaktanti) = (- 962)- (- 75) =
ΔHr° = - 887KJ / mol.
Reference
- Entalpija definicije reakcije. Opomogel od Thoughtco.com.
- (S.F.). Standardna entalpija reakcije. Okrevano od brezmejnega.com.

