Toplotno absorbirane formule, kako jo izračunati in rešiti vaje

- 5030
- 1072
- Barry Ernser
On absorbirana toplota Opredeljen je kot prenos energije med dvema telesom pri različnih temperaturah. Tista z nižjo temperaturo absorbira toploto kot pri višji temperaturi. Ko se to zgodi, se toplotna energija snovi, ki absorbira toploto, povečuje, in delci, ki jo sestavljajo.
To se lahko prevede v zvišanje temperature ali spremembo stanja. Na primer, premaknite se iz trdne do tekočine, na primer led, ko se pri sobni temperaturi stopi v stiku z vodo ali sodo.
 Kovinska čajna žlička absorbira toplo toploto kave. Vir: Pixabay.
Kovinska čajna žlička absorbira toplo toploto kave. Vir: Pixabay. Zahvaljujoč vročini je mogoče tudi, da predmeti spremenijo svoje dimenzije. Toplotna dilatacija je dober primer tega pojava. Ko se večina snovi segreje, običajno doživijo povečanje svojih dimenzij.
Izjema od tega je voda. Enaka količina tekoče vode poveča količino, ko se ohladi pod 4 ° C. Poleg tega lahko temperaturne spremembe doživijo tudi spremembe na ravni njihove gostote, kar je tudi v primeru vode zelo opaziti.
[TOC]
Kaj je in formule
V primeru energije v tranzitu so enote absorbirane toplote Joules. Vendar pa je imela toplota svoje enote: kalorija.
Še danes se ta enota uporablja za količinsko opredelitev vsebnosti energije v hrani, čeprav v resnici kalorija hrane ustreza kilokaloni toplote.
Kalorije
Kalorija, skrajšana kot apno, To je količina toplote, ki je potrebna za dvig temperature 1 grama vode za 1 ° C.
V devetnajstem stoletju je sir James Prescott Joule (1818 - 1889) izvedel znan eksperiment, v katerem mu je uspelo spremeniti mehansko delo v toploto in pridobil naslednjo enakovrednost:
1 kalorija = 4.186 Joules
V britanskih enotah se toplotna enota imenuje BTU (Britanska toplotna enota), ki je opredeljena kot količina toplote, potrebne za dvig temperature kilograma vode v 1 ° F.
Lahko vam služi: kalibracijska krivulja: za kaj je, kako to storiti, primeriEnakovrednost med enotami je naslednja:
1 btu = 252 kalorij
Težava teh starih enot je, da je količina toplote odvisna od temperature. To pomeni, da ni isto, ki je potrebna za prehod od 70 ° C do 75 ° C od tistega, ki je potrebna za ogrevanje vode od 9 ° C do 10 ° C, na primer.
Zato definicija predvideva dobro določene intervale: 14.5 do 15.5 ° C in 63 do 64 ° F za kalorijo oziroma BTU.
Kaj je odvisno od količine absorbirane toplote?
Količina absorbirane toplote, ki zbira material, je odvisna od več dejavnikov:
- Masa. Višja kot je masa, več toplote se lahko absorbira.
- Značilnosti snovi. Obstajajo snovi, ki so odvisno od njihove molekularne ali atomske strukture, ki lahko absorbirajo več toplote kot druge.
- Temperatura. Za dosego večje temperature je treba dodati več toplote.
Količina toplote, označena kot Q, Sorazmerna je z opisanimi dejavniki. Zato lahko pišete kot:
Q = m.c.ΔT
Kje m To je masa predmeta, c je konstanta klica Specifična toplota, lastna lastnost snovi in δT To je temperaturna nihanje, doseženo z absorpcijo toplote.
ΔT = tF - Ttudi
Ta razlika ima pozitiven znak, saj je pričakovati absorpcijo toplote TF > Ttudi. To se zgodi, če snov ne doživi fazne spremembe, na primer voda, ko parna tekočina prehaja. Ko voda zavre, njegova temperatura ostane konstantna pri približno 100 ° C, ne glede na to, kako hitro zavre.
Kako ga izračunati?
Če se obrneta na dva predmeta pri drugi temperaturi, čez nekaj časa dosežeta toplotno ravnovesje. Torej se temperature izenačijo in preneha prenos toplote. Enako se zgodi, če sta v stiku več kot dva predmeta. Po določenem času bodo vsi pri isti temperaturi.
Lahko vam služi: magnetizacija: orbitalni in vrteni magnetni trenutek, primeriOb predpostavki, da predmeti v stiku tvorijo zaprt sistem, iz katerega toplota ne more ubežati, se uporablja načelo ohranjanja energije, zato je mogoče potrditi:
Q absorbira = - q Sceding
To predstavlja energijsko ravnovesje, podobno kot vhodi in stroške osebe. Zato ima prenehana toplota negativen znak, saj je za predmet, ki daje, končna temperatura nižja od začetka. Zato:
ΔT = tF - Ttudi < 0
Enačba q absorbira = - q Sceding Uporablja se vsakič, ko sta dva predmeta v stiku.
Energijsko ravnovesje
Za izvedbo energetske ravnovesja je treba razlikovati predmete, ki absorbirajo toploto od tistih, ki pridelujejo, nato pa:
Σ qk= 0
To pomeni, da mora biti vsota povečanja energije in izgube v zaprtem sistemu enaka 0.
Specifična toplota snovi
Če želite izračunati količino absorbirane toplote, morate vedeti posebno toploto vsake sodelujoče snovi. To je količina toplote, potrebne za dvig temperature 1 g materiala za 1 ° C. Njegove enote v mednarodnem sistemu so: Joule/kg . K.
Obstajajo tabele s specifično toploto številnih snovi, na splošno izračunane z uporabo kalorimetra ali podobnih orodij.
Primer, kako izračunati določeno toploto materiala
Za dvig temperature kovinskega obroča od 20 do 30 ° C je potrebnih 250 kalorij. Če ima prstan maso 90 g. Kakšna je specifična toplotna toplota v enotah SI?
Rešitev
Enote so najprej pretvorjene:
Q = 250 kalorij = 1046.5 J
M = 90 g = 90 x 10-3 kg
Vam lahko služi: elastični pretresi: v dimenziji, posebni primeri, vaje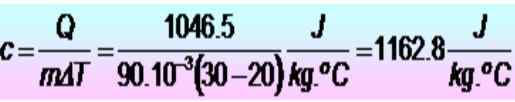
Vaja rešena
Aluminijasta skodelica vsebuje 225 g vode in 40 g bakrenega mešalnika, vse pri 27 ° C. V vodi je vzorec 400 g srebra pri začetni temperaturi 87 ° C.
Agitator se uporablja za mešanico, dokler ne doseže končne ravnotežne temperature 32 ° C. Izračunajte maso aluminijaste skodelice, če upoštevamo, da proti okolju ni toplotnih izgub.
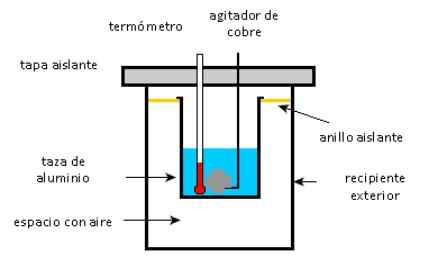 Shema kalorimetra. Vir: SolidSwiki.
Shema kalorimetra. Vir: SolidSwiki. Pristop
Kot je navedeno zgoraj, je pomembno razlikovati predmete, ki dajejo toploto od tistih, ki absorbirajo:
- Aluminijasta skodelica, baker in vodni agitator absorbira toploto.
- Srebrni vzorec daje toploto.
Podatki
Dobavljene so posebne toplote vsake snovi:
- Srebro: c = 234 j/kg. ºC
- Baker: C = 387 j/kg. ºC
- Aluminij C = 900 J/kg. ºC
- Voda c = 4186 j/kg. ºC
Toplota, ki jo vsaka snov absorbira ali dodeli, se izračuna z enačbo:
Q = m.c.λT
Rešitev
Srebro
Q Sceding = 400 x 10 -3 . 234 x (32 - 87) j = -5148 J
Bakreni agitator
Q absorbira = 40 x 10 -3 . 387 x (32 - 27) j = 77.4 J
Voda
Q absorbira = 225 x 10 -3 . 4186 x (32 - 27) j = 4709.25. J
Aluminijasta skodelica
Q absorbira = m Aluminij . 900 x (32 - 27) j = 4500 .m Aluminij
Uporaba:
Σ qk= 0
77.4 + 4709.25 + 4500 .m Aluminij = - (-5148)
Končno se očisti aluminijasta masa:
m Aluminij = 0.0803 kg = 80.3 g
Reference
- Giancoli, d. 2006. Fizika: načela z aplikacijami. 6th. Ed. Dvorana Prentice. 400 - 410.
- Kirkpatrick, l. 2007. Fizika: pogled na svet. 6ta Skrajšana izdaja. Cengage učenje. 156 - 164.
- Rex, a. 2011. Osnove fizike. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Univerzitetna fizika s sodobno fiziko. 14th. Zvezek1. 556 - 553.
- Serway, r., Vulle, c. 2011. Osnove fizike. 9na Cengage učenje. 362 - 374

