Komponenta verige elektronskih transportnih verig, zaporedje, zaviralci
- 1579
- 450
- Mr. Shane Larkin
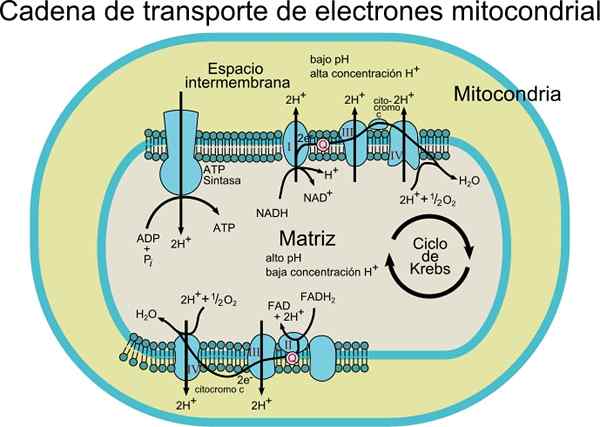
The veriga elektronskih transportnih verig Sestavljen je iz nabora molekul beljakovin in koencima znotraj membrane. Kot že ime pove, je odgovoren za prevoz elektronov iz koencimov NADH ali FADH2 do končnega sprejemnika, ki je O2 (molekularni kisik).
V tem transportnem procesu je energija, ki se sprosti s prenosom elektronov iz koencimov v molekularni kisik s pomočjo redoks centrov, združenih na beljakovine, povezana z proizvodnjo energije (ATP). To energijo dobimo zahvaljujoč protonskemu gradientu, ki nastane v notranji membrani mitohondrijev.
 Vir: Uporabnik: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/licence/by-sa/2.5)]
Vir: Uporabnik: Rozzychan [CC BY-SA 2.5 (https: // creativeCommons.Org/licence/by-sa/2.5)] Ta transportni sistem je sestavljen iz različnih komponent, ki jih najdemo v vsaj dveh stanjih oksidacije. Vsak od njih je med gibanjem elektronov iz NADH ali FADH2 do O2 učinkovito zmanjšan in ponovno oksid.
Koencime NAD+ in FAD se zmanjšajo na oksidacijski poti maščobnih kislin in ciklu citronske kisline, kar je posledica oksidacije različnih substratov. Nato se ti koencimi oksidirajo v elektronski transportni verigi.
Tako da je elektronski transportni sistem sestavljen iz zaporedja reakcij za zmanjšanje oksida, ki so med seboj povezane.
[TOC]
Verižne komponente
Glede na vrsto organizma je mogoče opaziti 3 do 6 komponent, ki predstavljajo verigo elektronskih transportnih verig. Proces prenosa elektronov in sinteza ATP z oksidativno fosforilacijo sta procesi, ki se pojavijo v membrani.
V primeru prokariotskih celic (aerobne bakterije) se ti procesi zgodijo povezani s plazemsko membrano. V evkariotskih celicah se pojavi v mitohondrijski membrani, zato komponente transporta elektronov najdemo v notranjem delu membrane.
https: // giphy.com/gifs/htksbbedquk9z7co5e
Elektroni se postopoma prenašajo prek štirih kompleksov, ki sestavljajo elektronsko transportno verigo.
Vsak kompleks ima več beljakovinskih komponent, povezanih s protetičnimi skupinami (neaminokislinske komponente konjugatnih beljakovin) redoks.
Poleg tega je ta transportni sistem sestavljen iz različnih molekulskih vrst, kot je flavoprotein; koencim, ki se imenuje tudi Ubiquinona (COQ ali UQ); različni citokromi, kot so citokrom B, C, C1, A in A3; Beljakovine s Fe-S in beljakovinskimi skupinami, povezanimi s CU. Te molekule so povezane z membrano, z izjemo citokroma c.
Kompleks i
https: // giphy.com/gifs/rlf1rl9gdc6356sj6w
Kompleks I, imenovan Nadh koencim kinona oksidortaduaza ali NADH dehidrogenaza, sestavlja približno 45 polipeptidnih verig in vsebuje mononukleotidno molekulo (FMN) in osem do devet Fe-S skupin Fe-S. Kot že ime pove, ta zapletena prenaša par elektronov iz nadh koencima v Coq.
Funkcija kompleksa NADH dehidrogenaze se začne z zvezo NADH do omenjenega kompleksa na strani notranje matrice mitohondrijske membrane. Elektroni se nato prepeljejo iz Nadha v FMN. Nato elektroni prehajajo od zmanjšanega flavina (FMNH2) na beljakovine Fe-S.
FMNH2 deluje kot nekakšen most med NADH in Fe-S proteini, saj lahko slednji prenese samo en elektron, medtem ko Nadh koencim prenaša dva, tako da Flavinas to prenese en sam elektron, zahvaljujoč svojemu Redoxu pol -cinona.
Vam lahko služi: monocytopoesis: stopnje, značilnosti, ureditevNazadnje se elektroni prenesejo iz združevanja Fe-S v koencim Q, ki je mobilni elektronski transporter z izopreneidnim repom, zaradi česar je hidrofobna, kar omogoča prečkanje središča mitohondrijske membrane.
Kompleks II

II kompleks, bolj znan kot sukcinatna dehidrogenaza, je integralni protein notranje membrane mitohondrij.
Ta kompleks je sestavljen iz dveh hidrofilnih podenot in dveh hidrofobnih skupin hemo B, ki zagotavljata vezavno mesto CoQ, poleg flavoproteina in beljakovin s Fe-S.
V ciklu citronske kisline (Krebs ali trikarboksilna kislina) se sukcinat pretvori v fumarat s sukcinatno dehidrogenazo, kar zmanjša koencim FAD na FADH2. Iz tega zadnjega koencima se elektroni prenesejo v centre Fe-S, ki jih nato prenesejo na Coq.
Med reakcijami tega prenosa elektronov je standardni redoks potencial zelo nizek, kar preprečuje, da bi se potrebna prosta energija sprostila za sintezo ATP.
To pomeni, da je kompleks II edini kompleks v transportni verigi elektronov, ki ne more zagotoviti energije za sintezo ATP. Vendar je ta kompleks ključnega pomena, saj prenaša elektrone iz FADH2 v preostali del verige.
Kompleks III
https: // giphy.com/gifs/cjg0raiuizjds2hkyu
III kompleks, citokrom kompleks BC1 ali coq citokrom c reduktaza, prenaša elektrone iz zmanjšanega koencima v citokrom C. Ta prenos se zgodi prek ene redoks ceste, ki je znana kot Q cikel.
Ta kompleks je sestavljen iz beljakovin s Fe-S in tremi različnimi citokromi, v katerem se železov atom, ki se nahaja v hemo skupini.
Citokromi so hemoproteini elektronskega transporta, ki imajo redoks aktivnost. Prisotni so v vseh organizmih, z izjemo nekaj obveznih anaerobov.
Ti proteini imajo hemo skupine, ki se izmenjujejo med dvema oksidacijskima stanjem (Fe2+ in Fe3+). Citokrom C je mobilni elektronski transporter, ki je šibko povezan z notranjo membrano mitohondrijev.
Citokromi, ki jih najdemo v tem kompleksu, so citokromi B, C in A, 3 so aktivni redoks beljakovine s skupinami, ki jih imamo različne značilnosti, ki izmenjujejo njihova oksidacijska stanja med Fe2+ in Fe3+.
Citokrom C je periferni membranski protein, ki deluje kot "shuttle" elektrona s citokromom C1 in s kompleksom IV.
IV kompleks
Citokrom C in O2 sta končni receptorji elektronov, ki izhajajo iz oksidacije organskega materiala, zato je kompleks IV ali citokroma C oksidaza končni encim v procesu elektronskega transporta. To sprejema elektrone iz citokroma C in jih prenese na zmanjšanje O2.
Kompleksna funkcija je katalizacija oksidacij elektrona štirih zaporednih molekul zmanjšanega citokroma C, to je hkrati zmanjšane štiri elektrone molekule O2, ki končno ustvarijo dva molekula H2O.
Vam lahko služi: tkivo epitelijskega premazaZaporedje prevoza elektronov
Elektroni se prenašajo iz kompleksov I in II v kompleks III zahvaljujoč koencimu Q, od tam pa prehajajo v kompleks IV prek citokroma C. Ko elektroni preidejo skozi te štiri komplekse, se redukcijski potencial poveča in sprošča energijo, ki se nato uporabi za sintezo ATP.
Skupno prenos nekaj elektronov povzroči premestitev 10 protonov skozi membrano; štirje v kompleksih I in IV ter dva kompleksa III.
NADH DESCIDROGENASA
Ta encim katalizira oksidacijo koencima NADH s koencimom. Elektroni se premikajo od NADH v FMN, ki je pritrjen na hidrofilni rep kompleksa I. Fe-s skupine Prenos na elektrone hkrati. Te skupine Fe-S se zmanjšujejo na COQ, ki je vgrajen v membrano, na ubikinol (reducirani coq).
Med prenosom elektronov na COQ se štirje protoni prenašajo skozi notranjo membrano v intermembranalni prostor. Mehanizem, s katerim so ti protoni premeščeni, vključuje beljakovine, ki se nahajajo v hidrofobnem repu kompleksa I.
Postopek prenosa elektronov v tem koraku sprošča prosta energija, zlasti -16,6 kcal/mol.
Coq-citocromo c reduktaza in q cikel
Koencim, ki ga oksidira citokrom c, v reakciji, ki jo katalizira ta koencim. Oksidacija ubikvinola (zmanjšano COQ) se pojavi na določenem mestu kompleksa (Qo ali oksidacijskega mesta) v mitohondrijski membrani, pri čemer prenašata dva elektrona, enega na beljakovine s skupinami Fe-S in drugim v hemo skupine hemo.
V ciklu Q oksidacija COQ proizvaja polikvinon, kjer se elektroni prenesejo v skupine Hemo B1 in BH. Medtem ko se ta prenos elektronov zgodi, drugi CoQ oksidira na mestu QO in ponavlja cikel.
Ta cikel povzroči prenos dveh elektronov in premestitev štirih protonov v intermembranalni prostor z sproščanjem -10,64 kcal/mol proste energije.
Citocrom C oksidaza
Ta encim (kompleks IV) katalizira oksidacijo citokroma C (zmanjšano) z O2, ki je končni sprejemnik elektronov. Ta prenos ustvari molekulo H2O za vsak par elektronov, prenesenih poleg premestitve protonov skozi membrano.
Elektroni se premikajo od enega do enega, od zmanjšanega citokroma C do para ionov CuA, nato pa preidejo v skupino hemo A in končno dosežejo binuklearno središče kompleksa, ki vsebuje Cub in Hemo A3 ione, kjer je prenos štiri Elektroni se pojavijo na kisiku.
V kompleksu IV elementi prenašajo elektrone enega za drugim, tako da se O2 postopoma zmanjšuje, tako da se sproščanje nekaterih strupenih spojin, kot so superoksid, vodikov peroksid ali hidroksilni radikali.
Energija, sproščena na tej stopnji, ustreza -32 kcal/mol. Elektrokemični gradient, ki nastane med postopkom prenosa, in spremembe energije (ΔE), ki jih povzroča nekaj elektronov, ko prehaja skozi štiri komplekse, v vsaki stopnji ustreza prosti energiji, potrebni za proizvodnjo molekule ATP.
Vam lahko služi: membranska teorija zlaganjaVelika dehidrogenaza
Kot rečeno, ima ta kompleks edino, a pomembno funkcijo uvedbe elektronov FADH2 iz cikla citronske kisline v transportno verigo elektronov.
Ta encim katalizira oksidacijo koencima FADH2 s koencimom Q (oksidirano). V ciklu citronske kisline, ko sukcinat v fumarate, se na modo preneseta dva elektrona in dva protona. Nato Fadh2 te elektrone prenese do CoQ do CO-S do Fe-S centrov kompleksa.
Končno se iz CoQ elektroni prenesejo v kompleks III po zgoraj opisanih korakih.
Verižni kompleksi so neodvisni
Štirje kompleksi, ki sestavljajo elektronsko transportno verigo, so neodvisni, to je, da so neodvisno in delujejo v notranji membrani mitohondrijev, gibanje vsakega od njih v membrani pa ni odvisno ali je povezano z drugimi kompleksi.
Kompleksi I in II se premikajo v membrani tako, da svoje elektrone prenesejo na COQ, ki se tudi širi v membrani in jih prenaša na kompleks III, od ko prehaja elektroni na citokrom c, ki je tudi mobilna v membrani in nahajajo elektroni v IV kompleksu.
Zaviralci elektronske transportne verige
V elektronski transportni verigi v svojem procesu delujejo nekateri specifični zaviralci. Rothenone je pogosto uporabljen insekticid, ki se stehiometrično pridruži kompleksu I in se izogne zmanjšanju COQ.
Nekatera barbiturata tipa zdravila, kot sta piericidin in amital, zavirajo kompleks I in posegajo v prenos elektronov iz skupin Fe-S v Coq.
V kompleksu II nekatere spojine, kot sta Theoiltrifluoroaceton in malonat.
Nekateri antibiotiki, kot sta miksotiazol in Stigmatellin, se vežejo na mesto Q COQ in zavirajo prenos elektronov iz koencima Q v centre Fe-S beljakovin.
Cianid, azida (N3-), žveplova kislina in ogljikov monoksid zavirajo kompleks IV. Te spojine se vežejo na hemo skupine, pri čemer se izogibajo prenosu elektronov na binuklearni center kompleksa ali kisika (O2) (O2).
Ko je veriga elektronskih transportnih verig zavira, se proizvodnja energije ustavi zaradi oksidativne fosforilacije, kar povzroči resno škodo in celo smrt organizma.
Reference
- Alberts, b., Bray, d., Hopkin, k., Johnson, a., Lewis, J., Raff, m., Roberts, k. & Walter, str. (2004). Bistvena celična biologija. New York: Garland Science. 2. izdaja.
- Cooper, g. M., Hausman, r. In. & Wright, n. (2010). Celica. (str. 397-402). Ed. Marbán.
- Devlin, t. M. (1992). Učbenik biokemije: s kliničnimi korelacijami. John Wiley & Sons, Inc.
- Garrett, r. H., & Grisham, c. M. (2008). Biokemija. Ed. Thomson Brooks/Cole.
- Rawn, j. D. (1989). Biokemija (št. 577.1 RAW). Ed. Medameriški-McGraw-Hill
- Voet, d., & Voet, J. G. (2006). Biokemija. Ed. Pan -american Medical.
- « Električne značilnosti anguile, habitat, razmnoževanje
- Značilnosti biozojev, morfologija, razmnoževanje, prehrana »

