Natrijev bromid (NABR)
- 2747
- 654
- Ricky Dach
Kaj je natrijev bromid?
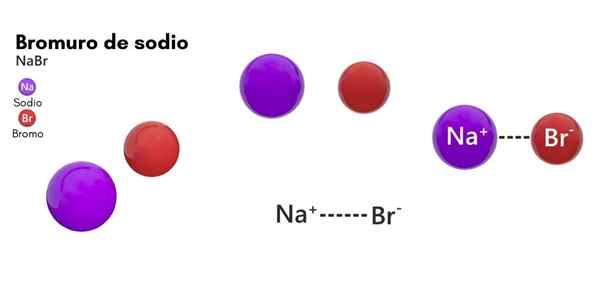
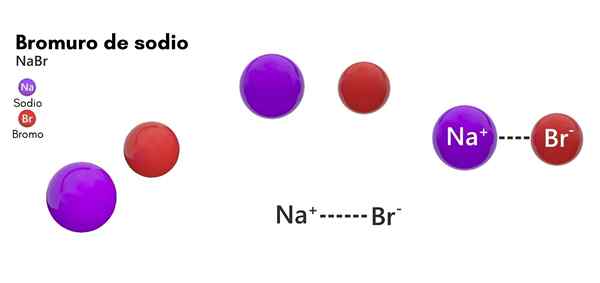
On Natrijev bromid Gre za kemijsko vrsto, ki spada v soli anorganskega izvora. Njegova struktura je sestavljena iz bromalnega halogena in natrijevega kovinskega elementa v 1: 1. Njegova kemična formula je NABAB in je v stanju trdnega združevanja v standardnih temperaturnih pogojih (25 ° C in 1 atm).
Običajno ga lahko opazimo kot beli prah in se šteje za kristalno spojino, ki kaže tudi higroskopsko vedenje; to pomeni, da lahko iz svoje okolice absorbira vlago.
Podobno ima natrijev bromid fizične lastnosti, ki so zelo podobne drugi ionski spojini iste kovine: natrijev klorid. Ta klorid je predstavljen kot NaCl, ki je bolj znan kot običajna sol ali namizna sol.
Ima veliko število uporab na različnih področjih znanosti; Na primer, uporablja se pri proizvodnji različnih vrst zdravil (sedativi, hipnotiki, antikonvulzivni, med drugim), kot pri organski sintezi in celo v aplikacijah za fotografiranje.
Kemična struktura
Natrijev bromid je predstavljen v trdni fazi in tako kot številne druge soli anorganske narave ima tudi kristalno strukturno konformacijo.
Ta kristalna molekula, ki jo sestavljata bromin in ena od vodika, ima kubično konformacijo, osredotočeno na obraze, kot so haloidne soli iste kovine (NAI, NAF in NACL).
Ta molekularna ureditev tvori strukturno osnovo številnih spojin, v katerih se izvaja vrstni red, tako da se vsak ion vzdržuje v središču oktaedrske slike, kot je prikazano na naslednji sliki.
Vam lahko služi: fosforna kislina (H3PO3)
V tej vrsti stekla lahko vidite, kako ima vsak ioni okoli njega še šest ionov - ki imajo nasprotno električni naboj -, ki se nahajajo na koncih oktaedrske figure.
Prav tako struktura te ionske snovi pomeni, da ima visoko tališče približno 747 ° C, ki je komercialno v svojih dveh oblikah: brezvodne vrste (brez molekul vode) in dihidrirane vrste (z dvema molekulama vode v svoji strukturni formuli (NABR · 2H2O)), katere točke združitve so različne.
Kemična sinteza
Natrijev bromid izvira s kemijsko reakcijo, ki se pojavi med vodikovim bromidom (BRH, vodikovega halogena v plinski fazi) in natrijevim hidroksidom (NaOH, močna podlaga v trdni fazi in s higroskopskimi lastnostmi).
Na ta način se proizvaja komercialno in doda presežek broma v raztopino NaOH. Tako nastane mešanica bromida/bromova. Nato so nastali izdelki podvrženi izhlapevanju, dokler se ne posušijo, in se obdelajo z ogljikom, da ustvarijo reakcijo bromatnega iona (Bro3-) do bromidnega iona (Br-).
Nevtralizacija
Podobno se lahko ta anorganska sol pojavi tudi z reakcijo nevtralizacije natrijevega karbonata (NA2Co3) Z bromovo kislino (hbro3), po istem opisanem postopku.
Skozi sintezo lahko to snov proizvajamo z reakcijo med železom z bromom in vodo. Kot produkt te reakcije izvirate železov -ferični bromid.
Vam lahko služi: alkoholiKasneje je ta vrsta nastala (predstavljena kot Feb2/Febr3) se raztopi v vodi in doda se določena količina natrijevega karbonata. Končno se raztopina filtrira in preide skozi postopek izhlapevanja, da končno dobimo natrijev bromid.
Lastnosti natrijevega bromida
- Običajno je v stanju trdnega združevanja, v obliki belega prahu.
- Ima kristalno strukturo, z molekularnim vrstnim redom v obliki kocke, osredotočene na obraze.
- Tališče te snovi je približno 747 ° C za brezvodno in 36 ° C obliko za obliko dihidrata, ki predstavlja razgradnjo, preden se stopi.
- Sestavljen je iz natrijevega iona (NA+) in bromidni ion (Br-), z molarno maso ali molekulsko maso 102,89 g/mol.
- Njegova vrelišča je precej visoka, opazuje 1390 ° C (enakovredno 2530 ° F ali 1660 K).
- Topnost te vrste znaša približno 94,32 g/100 ml vode pri 25 ° C, ko se temperatura poveča.
- Z ogrevanjem do točke, ko se pokvari, ta snov sprošča bromine pline in natrijev oksid, ki velja za strupeno.
- Gostota brezvodne oblike natrijevega bromida je 3,21 g/cm3, Medtem ko je dihidrirana spojina 2,18 g/cm3.
- Njegova topnost v alkoholu velja za zmerno, kot v drugih topilih, kot so piridin, amonijak in hidracija.
- Predstavlja netopnost proti acetonitrilu in acetonu.
Uporaba/aplikacije
- V medicinskem območju se uporablja kot zdravilo za veliko število pogojev, ki izvirajo iz napadov in kot terapijo za preprečevanje slik epilepsije pri bolnikih z Wolf-Hirschhorn sindromom, pa tudi za pomirjevalno in hipnotično zdravljenje.
Lahko vam služi: bromova kislina (Hbro3): lastnosti, tveganja in uporabe- V veterinarski medicini se uporablja pri psih, ki imajo konvulzivne motnje zaradi stranskih učinkov zdravil, kot sta primidon ali fenobarbital.
- Na področju naftne industrije se uporablja pri postopkih priprave nekaterih tekočin iz raznolike gostote, ki se uporabljajo v oljnih vrtinah.
- Na področju bioloških raziskav so bile dokazane njegove mikrobiocidne lastnosti; to pomeni, da se uporablja za nadzor razvoja različnih vrst bakterij.
- V določeni sintezi organskega tipa se ta anorganska sol uporablja za pripravo drugih vrst, ki jih sestavlja Bromo. Na primer, s Finkelsteinovo reakcijo dobimo določene reaktivne alkil halogenide, od katerih se je eden precej uporabljal pri fotografiji.
- Na območju čiščenja in dezinfekcije se natrijev bromid uporablja v kombinaciji s klorom za sanitarno količino vode, kot v bazenih in jacuzzis.