Kalcijev bikarbonat

- 3206
- 714
- Ms. Pablo Lebsack
 Kalcijev bikarbonat je anorganska sol bikarbonatne skupine
Kalcijev bikarbonat je anorganska sol bikarbonatne skupine Kaj je kalcijev bikarbonat?
On Kalcijev bikarbonat To je anorganska sol s CA Kemično formulo (HCO3)2. Iz narave izvira iz kalcijevega karbonata, ki je prisoten v apnenčastih in mineralnih kamnih, kot je kalcit.
Kalcijev bikarbonat je v vodi bolj topen kot kalcijev karbonat. Ta funkcija je omogočila nastanek kraskih sistemov v apnenčastih kamninah in pri strukturiranju jam.
Podzemna voda, ki prečka razpoke, nasiči v njihovem premiku ogljikovega dioksida (CO2).
Te vode izbrišejo apnenčaste kamnine, ki sproščajo kalcijev karbonat (Caco3), da se bo tvoril kalcijev bikarbonat, glede na naslednjo reakcijo:
Tat3(s) +co2(g) +h2Ali (l) => ca (hco3)2(aq)
Ta reakcija se pojavlja v jamah, kjer izvirajo zelo trde vode. Kalcijev bikarbonat ni v trdnem stanju, ampak v vodni raztopini, skupaj s CA2+, Bikarbonat (HCO3-) in karbonatni ion (CO32-).
Nato se z zmanjšanjem nasičenosti z ogljikovim dioksidom v vodi pojavi obratna reakcija, to je transformacija kalcijevega bikarbonata v kalcijev karbonat:
CA (HCO3)2(aq) => co2 (g) +h2Ali (l) +caco3 (S)
Kalcijev karbonat je v vodi malo topen, kar povzroči, da se padavine pojavijo kot trdna snov. Prejšnja reakcija je zelo pomembna pri tvorbi stalaktitov, stalagmitov in druge debeline v jamah.
Te skalne strukture so nastale iz kapljic vode, ki padajo s stropa jam. Caco3 prisoten v kapljicah vode je kristaliziran, da tvori prej omenjene strukture.
Dejstvo, da ne najdemo kalcijevega bikarbonata v trdnem stanju, je oviralo njegovo uporabo in v tem pogledu našli malo primerov.
Struktura kalcijevega bikarbonata
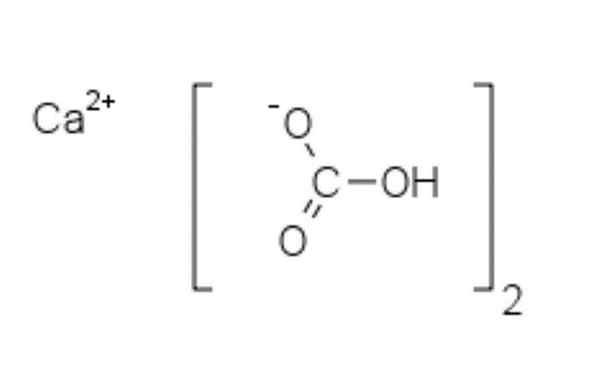 Kemična struktura kalcijevega bikarbonata
Kemična struktura kalcijevega bikarbonata Na zgornji sliki sta prikazana dva aniona HCO3- in karacija2+ interakcijo elektrostatično. Ca2+, Glede na sliko bi morala biti nameščena na sredini, saj tako HCO3- Ne bi se odbijali med seboj zaradi negativnih stroškov.
Negativna obremenitev v HCO3- Preseli se med dva atoma kisika, z resonanco med karbonilno C = O skupino in povezavo C-O-; medtem ko je v co32-, To se preseli med tremi atomi kisika, saj je vezava C-O nezaščitena in lahko dobi negativno resonančno obremenitev.
Lahko vam postreže: difenilaminGeometrije teh ionov lahko štejemo za kalcijeve kroglice, obkrožene z ravnimi karbonatnimi trikotniki s hidrogeniranim koncem. Glede na velikost velikosti je kalcij izjemno manjši od HCO ionov3-.
Vodne rešitve
Kalcijev bikarbonat Ne morete oblikovati kristalnih trdnih snovi in res je sestavljena iz vodnih raztopin te soli. V njih ioni niso sami, kot na sliki, ampak obkroženi z molekulami H2Tudi.
Vsak ion je obdan s hidracijsko sfero, ki bo odvisna od kovine, polarnosti in strukture raztopljenih vrst.
Ca2+ Koordinira s kisikovimi atomi vode, da tvori akkokompleks, CA (OH2)n2+, kjer se N običajno šteje za šest; to je "vodni oktaedro" okoli kalcija.
Medtem ko HCO anioni3- Dobro delujejo, bodisi z vodikovimi mostovi (ali2Co-H-OH2) ali z vodikovimi atomi vode v smeri negativne obremenitve (HOCO2- H-OH, Dipole interakcija).
Te interakcije med CA2+, HCO3- In voda je tako učinkovita, da v tem topilu naredijo kalcijev bikarbonat zelo topni; Za razliko od kalcijevega karbonata (Caco3), v kateri so elektrostatične znamenitosti med CA2+ in co32- So zelo močni, kar obori vodno raztopino.
Poleg vode obstajajo co -molekule2 naokoli, ki počasi reagira, da prispeva več HCO3- (Odvisno od vrednosti pH).
Hipotetična trdna snov
Zaenkrat velikosti in obremenitve ionov v kalcijevem bikarbonatu, niti prisotnosti vode, pojasnjujejo, zakaj ni trdne spojine; to pomeni, da čisti kristali, ki jih lahko označimo s kristalografijo X -Ray. Kalcijev bikarbonat ni nič drugega kot ioni, ki so prisotni v vodi, iz katerih kavernozne tvorbe še naprej rastejo.
DA CA2+ in HCO3- Lahko bi se izolirali od vode in se izognili naslednji kemični reakciji:
CA (HCO3)2(aq) → caco3(s) + co2(g) + h2Ali (l)
Potem bi jih lahko združili v belo kristalno trdno s stehiometričnimi razmerji 2: 1 (2HCO3/1CA).
Vam lahko služi: 30 primerov kemičnih suspenzijŠtudij o njegovi strukturi ni, vendar bi jo lahko primerjali z natrijevim bikarbonatom (kot magnezijev bikarbonat, MG (HCO3)2, niti ne obstaja kot trdno) ali s kalcijevim karbonatom.
Stabilnost: natrijev bikarbonat (Nahco3) VS. Kalcijev bikarbonat (CA (HCO3)2)
Natrijev bikarbonat kristalizira v monokliničnem sistemu, kalcijev bikarbonat pa v trigonalnem (kalcitu) in ortrombičnem sistemu (aragonit).
Če je na zamenjavo+ za ca2+, Kristalno omrežje bi destabilizirali z večjo razliko v velikostih; Se pravi, Na+ Ker je manjši, tvori bolj stabilen kozarec s HCO3- v primerjavi s CA2+.
Pravzaprav CA (HCO3)2(aq) potrebuje vodo, da izhlapi, tako da se lahko njene ione združijo v kozarec; Toda kristalna mreža tega ni dovolj močna, da bi to storila pri sobni temperaturi. Pri segrevanju vode pride do reakcije razgradnje (enačba od zgoraj).
Biti ion na+ V raztopini bi to tvorilo kozarec s HCO3- pred toplotno razgradnjo.
Razlog, zakaj se kalcijev bikarbonat ne kristalizira (teoretično), je zaradi razlike ionskih radijskih sprejemnikov ali velikosti njihovih ionov, ki pred razgradnjo ne morejo tvoriti stabilnega kristala.
Kalcijev bikarbonat (CA (HCO3)2) VS. kalcijev karbonat (caco3)
Če na drugi strani dodamo h+ Na kristalne strukture kalcijevega karbonata bi drastično spremenili svoje fizikalne lastnosti. Morda njihova tališča znatno padejo in celo morfologije kristalov končajo.
Fizikalne in kemijske lastnosti
Kemična formula
CA (HCO3)2
Molekularna teža
162,11 g/mol
Fizično stanje
Se ne pojavlja v trdnem stanju. Najdemo ga v vodni raztopini, in ko se toplota nanese za izhlapevanje, postane kalcijev karbonat.
Topnost vode
16,1 g/100 ml pri 0 ° C; 16,6 g/100 ml pri 20 ° C in 18,4 g/100 ml pri 100 ° C.
Te vrednosti kažejo na veliko afiniteto molekul vode z ioni kalcijevega bikarbonata, kot je razloženo v prejšnjem razdelku. Medtem se le 15 mg kalcijevega karbonata raztopi v litru vode, kar odraža njegove močne elektrostatične interakcije.
Ker kalcijev bikarbonat ne more tvoriti trdne snovi, njegove topnosti ni mogoče eksperimentalno določiti.
Vendar glede na pogoje, ki jih je ustvaril CO2 Raztopljen v vodi, ki obdaja apnenec, je mogoče izračunati maso kalcija, raztopljenega pri temperaturi T; masa, ki bi bila enaka koncentraciji kalcijevega bikarbonata.
Vam lahko služi: benzična kislina: sinteza, prenos in uporabaPri različnih temperaturah se raztopljena masa poveča, kot je prikazano v vrednostih pri 0, 20 in 100 ° C. Potem je po teh poskusih določeno, koliko kalcijevega bikarbonata Raztopi se v bližini kalcijevega karbonata, v vodnem mediju, uplinjenem s CO2.
Ko se Co pobegne2 Plinasti, kalcijev karbonat bo oboril, ne pa kalcijevega bikarbonata.
Fusion in vrelišča
Kristalna mreža CA (HCO3)2 Je veliko šibkejša od caco3. Če bi ga lahko dobili v trdnem stanju in izmerili temperaturo, pri kateri se topi znotraj vira, bi bila vrednost zagotovo pridobljena precej pod 899 ° C. Prav tako je treba pričakovati enako pri določanju vrelišča.
Točka zgorevanja
Ni gorivo.
Tveganja
Ker ta spojina ne obstaja trdno, je malo verjetno, da predstavlja tveganje za manipulacijo s svojimi vodnimi rešitvami, saj oba iona CA2+ Kot HCO3- Niso škodljivi za nizke koncentracije; In zato bi lahko bilo največje tveganje, ki bi bilo zaužitje takšnih rešitev, posledica nevarnega odmerka zaužitja kalcija.
Če je spojina tvorila trdno snov, celo morda fizično drugačna od Caco3, Njeni strupeni učinki po fizičnem stiku ali vdihavanju ne bi mogli preseči preprostega nelagodja in resekcije.
Prijave
- Kalcijeve bikarbonatne raztopine že dolgo uporabljajo za pranje starodavnih dokumentov, zlasti umetniških del ali zgodovinsko pomembnih dokumentov.
- Pri preprečevanju osteoporoze so bile uporabljene bikarbonatne raztopine. Vendar pa so v enem primeru v enem primeru opazili stranske učinke, kot so hiperkalcemija, presnovna alkaloza in odpoved ledvic.
- Kalcijev bikarbonat občasno in intravensko popravimo depresivni učinek hipokalemije na delovanje srca.
- Uporablja se za umirjanje želodčne kislosti.
Reference
- Wikipedia (2018). Kalcijev bikarbonat. Vzeto od: v.Wikipedija.org
- Sirah Dubois (3. oktober 2017). Kaj je kalcijev bikarbonat? Okrevano od: Livestrong.com
- Science Learning Hub (2018). Karbonatna kemija. Okrevano od: Scientilarn.org.nz
- Pubchem (2018). Kalcijev bikarbonat. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov

