Zgodovina benzena, struktura, lastnosti, derivati, uporabe

- 5084
- 868
- Ignacio Barrows
On benzen Gre za organsko spojino, ki je sestavljena iz enega najpreprostejših aromatičnih ogljikovodikov. Njegova kemična formula je c6H6, od katerih je znano, da je razmerje med ogljikom in vodikom enako 1; to pomeni, da je za vsak ogljik s tem povezan vodik.
Čeprav je njegov fizični videz brezbarvna tekočina, ga seveda najdemo v olju in izdelkih, ki izhajajo iz njega. Njen vonj je zelo značilen, saj spominja na mešanico lepila, bitumna in bencina; Po drugi strani je nestanovitna in vnetljiva tekočina.
 Belfing z benzenom. Vir: AIR1404 [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)]
Belfing z benzenom. Vir: AIR1404 [CC do 4.0 (https: // creativeCommons.Org/licence/by/4.0)] Na zgornji sliki je prikazana posoda ali steklenica z benzenom, predvidoma neanalitična čistost. Če se v laboratoriju takoj odkrijejo benzenske hlape. Zaradi tega se ta tekočina, ki se običajno uporablja kot preprosto topilo, manipulira v zvoncu za ekstraktor plina.
Biti tvoja formula c6H6, Kemikalije iz devetnajstega stoletja so vzgajale številne možne strukture, ki ustrezajo omenjenemu deležu c/h, ki je enak 1. Ne samo to, ampak molekula benzena je morala imeti posebne povezave tako, da je bilo mogoče pojasniti njeno nenavadno stabilnost z reakcijami dodajanja; značilno za alkene in politike.
Tako, da so njegove povezave predstavljale enigmo za kemikalije tistega časa; Dokler nepremičnina ne pokliče aromatičnost. Preden se šteje.
V organski kemiji je benzen klasičen simbol, strukturna podlaga za več polilaromatskih spojin. S šesterokotnikom se simfini derivatov pridobijo z aromatično elektrofilno substitucijo; Prstan, katerega robovi mejijo na strukturo, ki definira nove spojine.
Pravzaprav so njegovi derivati dolžni veliki industrijski uporabi za tiste, ki potrebujejo benzen med svojim surovinim materialom. Od priprave tekstilnega lepila in vlaken, do plastike, gub, pigmentov, drog in eksploziva. Po drugi strani pa seveda benzen najdemo v vulkanih, gozdnih požarih, bencinu in v dimu cigaret.
[TOC]
Zgodovina
Odkritje in imena
Njegovo odkritje sega v leto 1825, ki ga je običajno podelil Michaelu Faradayu, ko je zbral in naredil eksperimente s preostalim naftnim proizvodom plina, ki se uporablja za razsvetljavo. Ta tekočina je vsebovala delež c/h blizu 1, zato ga je poimenovala "uplinjač vodik".
Kemik Auguste Laurent je imenoval čuden ogljikovodik 'feno', ki izhaja iz grške besede 'Phaínein„Kaj pomeni briljantno (ker je bilo pridobljeno po zgorevanju plina). Vendar znanstvena skupnost tega imena ni sprejela le kot "fenil".
Iz benzoinske gume je kemik Eilhard Mitscherlichu devet let pozneje uspel izdelati isto spojino; Zato je obstajal še en vir za isti ogljikovodik, ki ga je krstil kot "Benzina". Vendar tudi niso upoštevali ustreznega imena za domnevo, da gre za alkaloid, na primer kinin.
Tako so ime 'Bencina' zamenjali z 'benzol'. Vendar so se spet pojavila protislovja in neskladja, ker je izraz "benzol" zmedel ogljikovodik za alkohol. Takrat se je rodilo ime "benzene", najprej uporabljeno v Franciji in Angliji.
Lahko vam služi: litijev karbonat (li2CO3): struktura, lastnosti, uporabeIndustrijska proizvodnja
Niti osvetlitev plina niti benzoinski gumi niso bili primerni viri za ustvarjanje benzena na velikih tehtnicah. Charles Mansfield, ki je sodeloval z August Wilhelm von Hofmann, je leta 1845 dosegel izolat benzena (dvajset let po njegovem odkritju) Hulla Tar, stranski produkt proizvodnje koksa.
Tako se je industrijska proizvodnja benzena začela iz Hulla Tar. Razpoložljivost benzena v ogromnih količinah, olajšala preučevanje svojih kemijskih lastnosti in ji omogočila, da ga poveže z drugimi spojinami podobnih reaktivnosti. August Wilhelm von Hofmann je skoval besedo "aromatičen" za benzen in sorodne spojine.
Zgodovinske strukture
Sanje avgusta Kekuléja
Friedrich August Kekulé je okoli leta 1865 prejel šesterokotno in ciklično strukturo benzena, ki izhaja iz čudnih sanj z Uroborosom, kačo, ki ugrizne svoj rep, tako da riše krog. Tako je verjel, da bi benzena mogoče obravnavati kot šesterokotni obroč, druge kemikalije pa so dvignile možne strukture, ki so prikazane spodaj:
 Strukture benzenskih obročev, predlagane skozi zgodovino. Vir: Jü [javna domena]
Strukture benzenskih obročev, predlagane skozi zgodovino. Vir: Jü [javna domena] Nekatere zgornje strukture bi lahko upravičile stabilnost benzena.
Knjiga, prstani in prizma
Upoštevajte, da tretja struktura sploh ni prstan, ampak trikotna prizma, ki jo je predlagal Albert Ladenburg leta 1869; Na levi strani odprta knjiga, ki jo je predlagal sir James Dewar leta 1867; In na njegovi desni strani, ena z vsemi hidrogeni, usmerjenimi proti središču obroča, ki ga je predlagal Henry Edward Armstrong leta 1887.
Prva struktura, ki jo je predlagal Adolf Karl Ludwig Claus leta 1867. In zadnji je bil Kekuléjev "serpentinski" prstan, sanjal leta 1865.
Kaj je bil "zmagovalec"? Peta struktura (od leve proti desni), ki jo je leta 1899 predlagal Johannes Thiele.
V tem je bil prvič upoštevan resonančni hibrid, ki sta združila dve Kekuléjevi strukturi (prvi obroč obrnil na desno, da ga je opazil) in izredno razložil selitev elektronov in z njim do takrat nenavadna stabilnost benzen.
Benzenska struktura
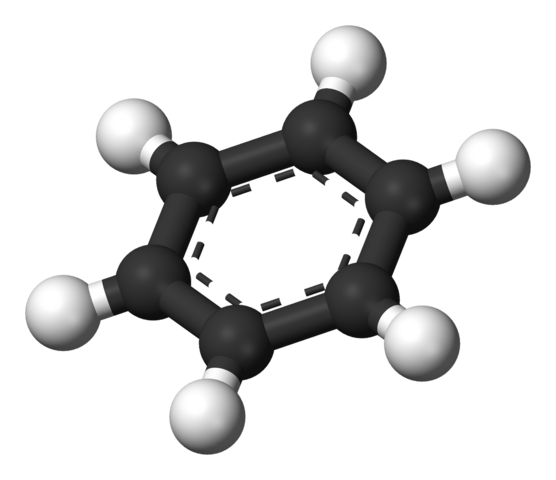 Benzenski aromatični prstan. Vir: Benjah-BMM27 [javna domena]
Benzenski aromatični prstan. Vir: Benjah-BMM27 [javna domena] Struktura, ki jo je predlagal Thiele.
Molekula benzena je ravna, z atomi vodika, ki kažejo na stranice obroča. Vsi atomi ogljika imajo hibridizacijo SP2, Z orbitalom str Na voljo za vzpostavitev aromatičnega sistema, v katerem se preseli šest elektronov.
Ti Carbonos sp2 So bolj elektronegativni kot vodiki, zato prvi odstrani elektronsko gostoto za slednje (cSp2δ--Hδ+). Posledično ima središče obroča večjo koncentracijo elektronov kot njene strani.
Natančneje, aromatični sistem je lahko predstavljen kot oblak ali elektronska blazinica, razširjena z obema stranema šesterokotnega obroča; in na sredini, ob straneh ali robovih, elektronsko pomanjkanje, ki ga tvorijo vodiki s pozitivno delno obremenitvijo.
Zahvaljujoč tej porazdelitvi električnih nabojev lahko benzenske molekule medsebojno medsebojno komunicirajo prek dipol-dipolo sil; Atomi hδ+ Občutijo privlačnost do aromatičnega središča sosednjega obroča (pod tem bo predstavljeno).
Prav tako lahko aromatična središča zložimo drug na drugega, da se naklonijo indukciji takojšnjih dipolov.
Vam lahko služi: alotropijaResonanca
 Strukture in resonančni hibrid benzena. Vir: Edgar181 iz Wikipedije.
Strukture in resonančni hibrid benzena. Vir: Edgar181 iz Wikipedije. Dve konstrukciji Kekulé sta prikazani na vrhu slike, pod njimi pa resonančni hibrid. Ker se obe strukturi vedno znova dogajata hkrati, je hibrid predstavljen s krogom, narisanim na sredini (podobno kot "šesterokotni krof").
Hibridni krog je pomemben, ker označuje aromatični značaj benzena (in številnih drugih spojin). Poleg tega poudarja, da povezave niso tako dolge kot C-C, niti kratke kot C = C; Toda njihova dolžina je med obema koncima. Tako benzen ne velja za polihena.
Zgoraj je bilo dokazano z merjenjem dolžin C-C povezav (139 PM) benzena, ki so nekoliko bolj podolgovate kot C-H vezi (109 PM).
Kristali
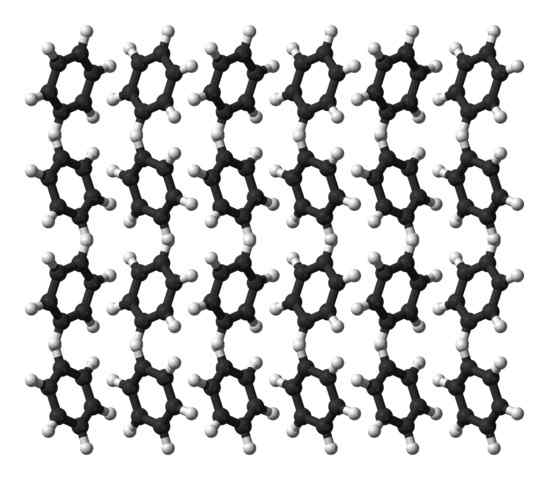 Benzene ortorrombična kristalna struktura. Vir: Ben Mills [javna domena]
Benzene ortorrombična kristalna struktura. Vir: Ben Mills [javna domena] Benzen je tekočina pri sobni temperaturi. Njegove medmolekularne sile, čeprav ima tako izrazit dipolski trenutek, lahko molekule drži skupaj v tekočini, ki zavre pri 80 ° C. Ko temperatura pade pod 5 ° C, se benzen začne zmrzovati: in tako dobijo njihovi ustrezni kristali.
Benzenski obroči lahko sprejmejo strukturne vzorce, opredeljene v njihovi trdni snovi. Njihovi dipoli jih naredijo "nagnjeni" v levo ali desno in tvorijo vrste, ki se lahko reproducirajo z ortromnormorsko celico. Tako so benzenski kristali ortorrambični.
Na vrhunski sliki upoštevajte, da ko so obroči nagnjeni k naklonjenosti interakcijam med Hδ+ in aromatična središča, omenjena v prejšnjih podsektorjih.
Lastnosti
Molekularna masa
78,114 g/mol.
Fizični videz
Brezbarvna tekočina z vonjem, podobnim bencinu.
Vrelišče
80 ° C.
Tališče
5,5 ° C.
točka vžiga
-11 ° C (zaprta skodelica).
Temperatura samoificiranja
497,78 ° C.
Gostota
0,8765 g/ml pri 20 ° C.
Topnost
Liter vrele vode komaj raztaplja 3,94 g benzena. Njegov apolarni značaj je praktično nepomembno z vodo. Vendar je mešljiv z drugimi topili, kot so etanol, etri, aceton, olja, kloroform, ogljikov tetraklorid itd.
Gostota hlapov
2.8 v zračnem odnosu (to je skoraj trikrat več).
Parni tlak
94,8 mm Hg pri 25 ° C.
Toplota zgorevanja
-3267,6 kJ/mol (za tekoči benzen).
Toplota za uparjanje
33,83 kJ/mol.
Površinska napetost
28,22 mn/m a 25 ° C.
Lomni količnik
1.5011 do 20 ° C.
Odvod

Benzenske vodike lahko nadomestijo z drugimi skupinami ali atomi. Lahko obstaja ena ali več substitucij, ki povečajo stopnjo zamenjave do šestih prvotnih vodikov.
Na primer, Benceno kot ph-H, kjer je h kateri od svojih šestih vodikov. Če se spomnimo, da ima središče obroča večjo elektronsko gostoto, privabi elektrofile, ki napadajo obroč, da nadomestijo H v reakciji, imenovani aromatična elektrofilna substitucija (SEAR).
Če bo ta h nadomeščen z OH, bo Ph-OH, bo imel fenol; Zamenjava CHO3, Ph-ch3, Toluen; Če je NH2, PH-NH2, anilin; Ali če je CHO2Pogl3, Ph-ch2Pogl3, Etilbenzen.
Derivati so lahko enaki ali bolj strupeni kot benzen ali nasprotno, postanejo tako zapleteni, da postanejo zaželeni farmakološki učinek.
Vam lahko služi: kalcijev karbid (CAC2): struktura, lastnosti, pridobivanje, uporabePrijave
To je dobro topilo za najrazličnejše spojine, ki so prisotne na primer na slikah, lakov, lepila in premazov.
Prav tako lahko raztopi olja, maščobe ali voske, tako da je bila uporabljena kot topilo za ekstraktor Essence Extractor. To lastnost je Ludwig Roselius leta 1903 uporabil za kofein kave, operacijo, ki je bila že v uporabi zaradi strupenosti benzena. Prav tako so ga v preteklosti uporabljali za razmasnjo kovine.
V eni od svojih klasičnih uporabe ne deluje kot topilo, ampak kot dodatek: povečajte oktano bencina in nadomestite svinca v ta namen.
Benzenski derivati imajo lahko različne uporabe; Nekateri služijo kot pesticidi, maziva, detergenta, plastika, eksplozivi, parfumi, barvila, lepilo, droge itd. Če v svoji strukturi obstaja benzenski obroč, je povsem verjetno, da je njegova sinteza zapustila benzen.
Med njegovimi najpomembnejšimi derivati so: Cumeno, ksilen, anilin, fenol (za sintezo fenolnih smol), benzojska kislina (konzervativca), ciklohekan (za sintezo nilona), nitrobenzen, resorcinol in etilbenzen.
Nomenklatura
Nomenklatura derivatov benzena se razlikuje glede na stopnjo substitucije, kakšne so nadomestne skupine in njihovi relativni položaji. Tako lahko benzen utrpi opico, di, tri, tetra itd., Zamenjave
Ko sta obe skupini povezani s sosednjimi ogljiki, se uporablja oznaka „Ortho“; Če je med njimi ločevanje ogljika, 'cilj'; In če so ogljikovi v nasprotnih položajih, 'za'.
Na spodnjih slikah so prikazani primeri derivatov benzena z njihovimi imeni, ki jih ureja IUPAC. Spremljajo jih tudi običajna ali tradicionalna imena.
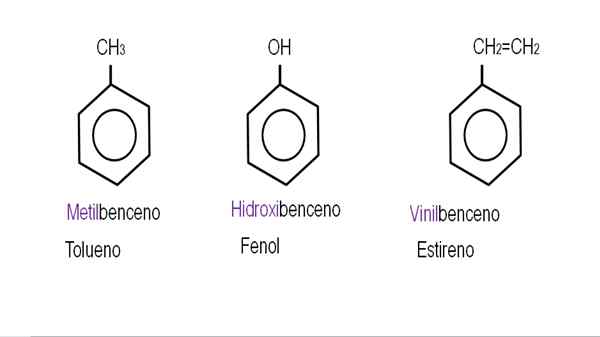 Monoderivirani benzen. Vir: Gabriel Bolívar.
Monoderivirani benzen. Vir: Gabriel Bolívar. 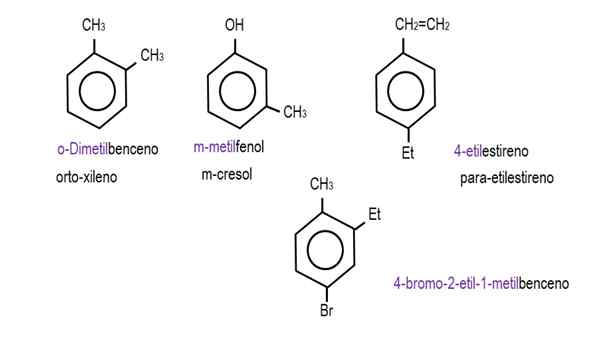 Drugi benzenski derivati. Vir: Gabriel Bolívar.
Drugi benzenski derivati. Vir: Gabriel Bolívar. Upoštevajte, da v trisustiranju Benzene Ortho indikatorji, za in cilj ne prenehajo biti koristni.
Strupenost
Benzen je spojina, ki jo je treba skrbno manipulirati. Glede na njegov poseben vonj so lahko neposredni negativni učinki zadušitev, omotica, glavoboli, tresenje, zaspanost, slabost in celo smrt (pred visoko izpostavljenostjo). Če lahko poleg tega, kar je bilo že omenjeno, bolečine v želodcu in napadi povzročijo akutno.
Poleg tega so dolgoročni učinki v konstantni izpostavljenosti tej tekočini rakotvorni; Povečuje možnosti, da posameznik trpi zaradi neke vrste raka, zlasti krvi: levkemija.
V krvi lahko zmanjša koncentracijo rdečih krvnih celic, ki povzroča anemijo, in vpliva tudi na kostni mozeg in jetra, kjer ga telo asimilira, da ustvari še bolj strupene derivate benzena; Na primer hidroksikinon. Se kopiči tudi v ledvicah, srcu, pljučih in možganih.
Reference
- Morrison, r.T. In Boyd, r. N. (1987). Organska kemija. (5. izdaja). Addison-Wesley Iberoamericana.
- Carey, f. Do. (2008). Organska kemija. (6. izdaja). McGraw-Hill, Intermerica, uredniki S.Do.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Nacionalni center za informacije o biotehnologiji. (2019). Benzen. Baza podatkov Pubchem. Cid = 241, obnovljen od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2019). Benzen. Pridobljeno iz: v.Wikipedija.org
- Garcia nissa. (2019). Kaj je benzen? - Uporaba, struktura in formula. Študij. Okrevano od: študij.com
- Centri za nadzor in preprečevanje bolezni. (4. april 2018). Dejstva o benzenu. Obnovi se od: nujne primere.CDC.Gov
- Svetovna zdravstvena organizacija. (2010). Izpostavljenost benzenu: glavna vprašanja javnega zdravja. [PDF]. Okreval od: kdo.int
- Fernández Germán. (s.F.). Težave z nomenklaturo benzena. Organska kemija. Okrevano od: Chemicicaorganica.org
- « Koncept kozmopolitizma, izvor, vizija Kanta, družbe
- Turistična geografija Predmet študija, izvor, pomožne znanosti »

