Natrijeva azida (NAN3) struktura, lastnosti, uporabe, tveganja

- 1581
- 266
- Lee Farrell
The Natrijev azid To je kristalna anorganska trdna snov, ki jo tvori natrijev ion Na+ In azida n ion3-. Njegova kemična formula je nan3. Nan spojina3 To je natrijeva sol Hn hidrazojske kisline3. Nan3 Je kristalna trdna snov brez barvne do bele.
Čeprav gre za zelo strupeno spojino, je bila eno najbolj razširjenih delovnih mest v zračnih blazinah, ki so takoj okužene med nesrečami na vozilih. Služi tudi za hitro napihovanje zasilnih diapozitivov letala. Vendar je trenutno njegova uporaba v obeh primerih zelo pod vprašaj zaradi svoje strupenosti.
 Natrijev nan Azid3 trden. Ali.С. Nepokonov [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Natrijev nan Azid3 trden. Ali.С. Nepokonov [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Uporablja se v kemijskih raziskovalnih laboratorijih za sintezo različnih vrst spojin in v biokemijskih laboratorijih za študije z bakterijami, glivami ali sesalci ali človeškimi celicami.
V nekaterih laboratorijih se uporablja za sterilizacijo materialov ali opreme, vendar nekatere vrste mikroorganizmov se upirajo njihovemu biocidnemu delovanju.
V kmetijstvu se uporablja tudi za odpravo zajedavcev v tleh ali v lesni industriji, da prepreči, da bi se borov les obarval z glivami.
[TOC]
Struktura
Natrij azida nan3 Tvori jo natrijev na kation+ in azid anion n3-.
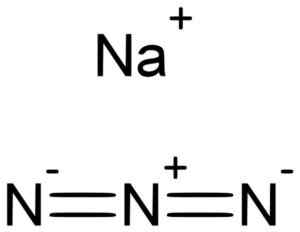 Natrijev azida tvori natrij NA+ In azida n ion3-. Lukáš Mižech [javna domena]. Vir: Wikimedia Commons.
Natrijev azida tvori natrij NA+ In azida n ion3-. Lukáš Mižech [javna domena]. Vir: Wikimedia Commons. Azida n ion3- Sestavljen je iz treh dušikovih atomov (n), ki jih združujejo medsebojno s kovalentnimi vezmi, ki so lahko preproste, dvojne ali trojne, saj se elektroni delijo med tremi.
Ta anion ima linearno strukturo, to je tri dušikove atome, razporejene v ravni črti. Poleg tega je struktura simetrična.
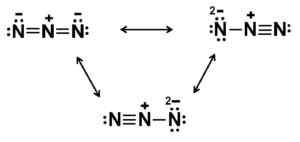 Možne Lewisove strukture Azida aniona. Avtor: Marilú Stea.
Možne Lewisove strukture Azida aniona. Avtor: Marilú Stea. Nomenklatura
- Natrijev azid
- Natrij azida
Lastnosti
Fizično stanje
Kristalno trdno brezbarvno do bele. Šesterokotni kristali.
Molekularna teža
65,01 g/mol
Tališče
Razpade pri 275 ° C.
Gostota
1.846 g/cm3 pri 20 ° C
Topnost
V vodi je zelo topen: 41,7 g/100 ml pri 17 ° C. V etanolu je rahlo topen in netopen v etil etra.
Konstante disociacije
Ima PKb 9.3. Vodne raztopine vsebujejo NH3, ki hitro uide okolju pri 37 ° C.
Kemične lastnosti
Nan3 Je zelo jedko do aluminija in zmerno do bakra in svinca.
Vam lahko služi: dušikove valenceGlede na določen vir, ki se je posvetoval, natrijev azid ni eksploziven. Nežno in v celoti se razgradi, ko se segreje pri 300 ° C ali več, tvori natrijevo kovino in dušikov plin n2.
2 nan3 → 2 Na + 3 n2↑
To je dušikovno sredstvo, to pomeni, da služi dušiku ali dodaja dušik drugim kemičnim spojinam ali na površino materialov, kot je jeklo.
Je stabilen v nevtralni ali alkalni vodi v odsotnosti svetlobe. Razpade skozi sončno sevanje.
Biokemične lastnosti
Natrijev azid zavira encim, imenovan citokrom oksidaza, ki ga najdemo v mitohondrijih celic in je pri tem pomembno vključen v dihanje in energijo.
Njegovo delovanje preprečuje, da bi nastajanje ATP ključno spojino v celičnih aktivnostih, celica pa se poslabša ali poškoduje.
Če ga zaužijemo, vdihavamo ali stikamo z natrijevim azidom, je zelo strupen in lahko postane smrtonosen.
Pridobivanje
NH amoniak reagira3 S kovinskim sodio NA pri 350 ° C v zaprti jekleni posodi, pri čemer dobimo amid iz natrijeve nanhe2.
Natrijeva nanh2 Reagira z diitrogenim monoksidom n2Ali pri 230 ° C v nikljenem reaktorju in tako nastane mešanica natrijeve nan3, Natrijev hidroksid NaOH in Amonijak NH3.
2 Nanh2 + N2O → nan3 + NaOH + NH3
Dobimo ga lahko tudi z reakcijo natrijevega amida z nano natrijevim nitratom3 pri 175 ° C:
3 Nanh2 + Starejši brat3 → nan3 + 3 NaOH + NH3
Za čiščenje azida se mešanici doda voda, kristali azida se operejo in nato voda izhlapi. Kristalni material, ki ostane, je azid natrijeve nan3 da se nato posuši pri 110 ° C.
Prijave
V motornih vozilih in letalih
Natrijev azid se v avtomobilski industriji pogosto uporablja kot generator dušika za hitro napihovanje zračnih blazin (angleščina Zračne blazine) Varnost avtomobilskih letakov in tovornjakov, ko pride do udarca.
Uporabljali so ga tudi v napihljivih diapozitivih, ki služijo za hitro pobeg iz notranjosti letal, ki so pristali v izrednih razmerah.
V obeh primerih mehanizem vključuje delovanje iskrice, da ustvari takojšnjo reakcijo med natrijevim azidom in določenimi spojinami, ki ustvarja dušikov plin n2 in natrijev oksid Na2Tudi.
Vam lahko služi: dvojna reakcija nadomestitveTa aplikacija zahteva takojšnjo sproščanje hladnega in netehničnega plina, zato je dušik najprimernejši plin.
 Varnostne vrečke, ki so bile že uporabljene v vozilih. Avtor: Marcel Langthim. Vir: Pixabay.
Varnostne vrečke, ki so bile že uporabljene v vozilih. Avtor: Marcel Langthim. Vir: Pixabay. Vendar se ta uporaba zmanjšuje zaradi toksičnosti natrijevega azida in se namesto tega uporabljajo manj strupene spojine.
V kemični industriji
Uporablja se kot zaviralca v proizvodnji gume za gobice, da prepreči koagulacijo razteznega ali butadienskega lateksa, ko so shranjeni v stiku s kovinami in razgradnji nitritov v prisotnosti nitratov.
V kmetijstvu
Uporablja se v kmetijstvu: kot biocidna in fumigantna je tudi nematicid, to je, da se v tleh uporablja za odpravo ogorčic, ki so zajedavci, ki napadajo nekatere pridelke.
 Škoda, ki jo povzročajo ogorčice v korenu rastline. Avtor: Redwolf. [http: // www.Ars-gin.Gov/ars/soatlantic/fp/stpp/birelle/birelle.html] Vir: Wikimedia Commons.
Škoda, ki jo povzročajo ogorčice v korenu rastline. Avtor: Redwolf. [http: // www.Ars-gin.Gov/ars/soatlantic/fp/stpp/birelle/birelle.html] Vir: Wikimedia Commons. Delula je tudi kot herbicid in se izognila gnilih sadju.
Pred kratkim Nan3 Uporabljala je pri pripravi semen okra ali Quimbombó, da bi opazovala njegovo odpornost na pogoje vode.
Semena, na katera je bila prej uporabljena Nan3 Ustvarili so sadike, ki so bolje umaknile poplavne razmere kot nerazumne, izboljšale višino rastlin, povečale število listov in povečale količino korenin tudi s presežkom vode.
Pri pripravi drugih kemičnih spojin
Uporablja se kot kemični reagent pri sintezi organskih spojin, na primer za pripravo številnih organskih azidov, kot so azidi terciarne alkilne skupine, ki so pomembni pri kemični sintezi.
Služi za pripravo hidrazojske kisline (HN3) in čisti natrij (NA).
V eksplozivni industriji
Natrij azida nan3 Je posrednik v eksplozivni proizvodnji, saj se uporablja za pripravo svinčevega Azida3)2. Slednje je spojina, ki eksplodira, ko močno pretepa, zato se uporablja pri gradnji eksplozijskih naprav.
 Natrij azida nan3 Uporablja se za izdelavo svinca PB (n3)2 spojina, ki je del naprav za ustvarjanje eksplozij. Avtor: OpenCLIPART-VEKTORJI. Vir: Pixabay.
Natrij azida nan3 Uporablja se za izdelavo svinca PB (n3)2 spojina, ki je del naprav za ustvarjanje eksplozij. Avtor: OpenCLIPART-VEKTORJI. Vir: Pixabay. V biokemijskih laboratorijih
Natrijev azid se uporablja, kadar je potrebna sterilna laboratorijska oprema, saj lahko uniči različne vrste mikroorganizmov.
Lahko vam služi: hipofiza (H3PO2): lastnosti, uporabe in reagentiTo je biocidno sredstvo. Vendar nekateri viri kažejo, da so nekatere vrste bakterij odporne na njihovo delovanje.
To dosežemo z blokiranjem vezave kisika v citokromu oksidaze, ki je encim, ki je vključen v proces proizvodnje energije nekaterih mikroorganizmov.
Uporablja se v samodejnih krvnih števcih, tudi pri diferencialni izbiri bakterij in ohranjanju rešitev laboratorijskih reagentov, ker preprečuje rast nekaterih mikroorganizmov v teh.
V več uporabi
Natrijeva azida servira v lesni industriji, da se izogne rasti rjavih gliv na borovem lesu.
Uporablja se tudi v japonski pivski industriji, da se izogne razvoju glive, ki zatemni, ki pije.
Tveganja
Natrijev azid je strupena spojina, ki zavira pomemben encim za dihanje in življenje človeških in živali. Ugotovljeno je bilo, da lahko resno vpliva na celične celice možganske krvne žile.
Njegov neposredni učinek po zaužitju, vdihavanju ali stiku s kožo je nevarno znižanje krvnega tlaka, kar lahko privede do smrti. Zato je treba manipulirati z veliko previdno.
Obstajajo viri informacij, ki pritegnejo pozornost na zračne blazine vozil, ki so uničena na odpadnih območjih.
V takih primerih bi ljudje, ki ne poznajo nevarnosti3, To je zelo strupena spojina. Poleg tega obstaja nevarnost kontaminacije z Nan3 tla in vode.
Prav tako bi lahko med nesrečami, trki ali požari na vozilih ljudje izpostavili Nan3 In to lahko podcenjuje ali neznano zdravstveno osebje, ki se udeležuje nujnih primerov.
Pozornost na razstavo laboratorijskega osebja, ki ga uporablja.
Reference
- Vwioko, e.D. et al. (2019). Natrijev azid povečuje stresno toleranco v Okra (Abelmoschus esculentus). Agronomy 2019, 9, 670. MDPI se je okreval.com.
- Kho, d.T. et al. (2017). Smrt endotelnih celic krvne možganske pregrade do natrijevega azida in njegovih plinastih produktov. Biosensors 2017, 7, 41. MDPI se je okreval.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Natrijev azid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Talavera, m. et al. (2019). Upravljanje ogorčic na jagodnih poljih južne Španije. Agronomy 2019, 9, 252. MDPI se je okreval.com.
- Okano, t. et al. (devetnajst devetdeset pet). Mehanizem odvajanja celic na temperaturno modulirane hidrofilne hidrofobne polimerne površine. V biomaterialih: Srebrni jubilejni zbornik. Okrevano od Scientirect.com.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A22. VCH Verlagsgellschaft MBH.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Chang, s. in lamm, s.H. (2003). Učinki človekovega zdravja izpostavljenosti natrijevega azida: pregled in analiza literature. Int J Toxicol 2003, 22 (3): 175–86. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.

