Anhidridi

- 4642
- 550
- Barry Ernser
Kaj so anhidridi?
The Anhidridi So kemične spojine, ki izvirajo iz združenja dveh molekul z osvoboditvijo vode. Tako ga je mogoče razumeti kot dehidracijo začetnih snovi; Čeprav ni ravno res.
V organski in anorganski kemiji so omenjeni in v obeh vejah se njihovo razumevanje v občutno razlikuje. Na primer, v anorganski kemiji veljajo za osnovne in kisle okside, kot so anhidriji njihovih hidroksidov in kislin.
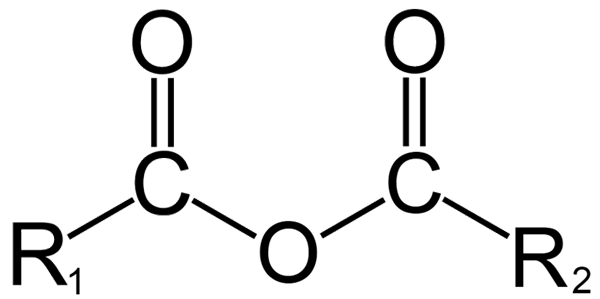 Splošna struktura anhidridov. Vir: Dremmetbrownie [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], iz Wikimedia Commons
Splošna struktura anhidridov. Vir: Dremmetbrownie [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], iz Wikimedia Commons Tu je mogoče ustvariti zmedo med izrazom „brezvodni“ in „anhidrido“. Na splošno se brezvodni nanaša na spojino, na katero je bila dehidrirana brez sprememb v svoji kemični naravi (ni reakcije); Medtem ko z anhidridom obstaja kemična sprememba, ki se odraža v molekularni strukturi.
Če primerjamo ustrezne hidrokside in kisline (ali anhidride). Po drugi strani so lahko nekateri oksidi ali soli hidrirani, izgubijo vodo in še naprej iste spojine; Toda brez vode, torej anhidros.
Po drugi strani je v organski kemiji tisto, kar anhidrid razume, začetna definicija. Na primer, eden najbolj znanih anhidridov je tisti, ki izhajajo iz karboksilnih kislin (vrhunska slika). Ti so sestavljeni iz združenja dveh acilnih skupin (-RCO) skozi atom kisika.
V svoji splošni strukturi je naveden r1 Za acilno skupino in r2 Za drugo skupino ACILO. Ker r1 in r2 So drugačni, prihajajo iz različnih karboksilnih kislin in potem je asimetrična kislina anhidrid. Ko sta oba substituenta r (ali sta aromatična) enaka, se v tem primeru govori o simetrični kislini anhidrid.
V času povezovanja dveh karboksilnih kislin, ki tvorijo anhidrid, se lahko tvori voda ali ne, pa tudi druge spojine. Vse bo odvisno od strukture teh kislin.
Lastnosti anhidrida
Lastnosti anhidridov bodo odvisne od tega, na katero se nanaša. Skoraj vsi imajo skupno, da reagirajo z vodo. Vendar pa je za tako imenovane osnovne anhidride v anorganskem, več jih je celo netopnih v vodi (MgO), zato se bo ta izjava osredotočila na anhidride karboksilnih kislin.
Fusion in vrelišča padajo na molekularno strukturo in intermolekulske interakcije za (RCO)2Ali pa je to splošna kemična formula teh organskih spojin.
Če molekularna masa (RCO)2Ali je nizka, verjetno je brezbarvna tekočina pri sobni temperaturi in tlaku. Na primer, ocetni anhidrid (ali Ehydridge3Co)2Ali pa je tekočina in najpomembnejša industrijska pomembnost, njegova proizvodnja pa je zelo obsežna.
Reakcija med ocetnim anhidridom in vodo je predstavljena z naslednjo kemijsko enačbo:
(Pogl3Co)2Ali + h2O => 2ch3COOH
Upoštevajte, da se ob dodajanju molekule vode sprostita dve molekuli ocetne kisline. Vendar se obratna reakcija ne more pojaviti za ocetno kislino:
Vam lahko služi: ravnovesje med tekočino in hlapom2ch3Cooh => (cho3Co)2Ali + h2Ali (se ne zgodi)
Potrebno se je zateči na drugo sintetično pot. Dikarboksilne kisline lahko to storijo s segrevanjem; Vendar bo razloženo v naslednjem razdelku.
Kemične reakcije
Hidroliza
Ena najpreprostejših reakcij anhidridov je njihova hidroliza, ki se je pravkar pokazala za ocetni anhidrid. Poleg tega primera obstaja tudi anhidrid žveplove kisline:
H2S2Tudi7 + H2Ali 2h2SW4
Tu imate anhidrid anorganske kisline. Upoštevajte, da za h2S2Tudi7 (imenovano tudi disulfrinska kislina), reakcija je reverzibilna, zato segrevanje h2SW4 koncentrat povzroči nastanek njegovega anhidrida. Če je po drugi strani razredčena raztopina H2SW4, Tako je izdano3, Žveplov anhidrid.
Esterifikacija
Kisli anhidridi reagirajo z alkoholi, s piridinom na sredini, da bi povzročili ester in karboksilno kislino. Na primer, upošteva se reakcija med ocetnim anhidridom in etanolom:
(Pogl3Co)2Ali + ch3Pogl2OH => CHO3Co2Pogl2Pogl3 + Pogl3COOH
Tako tvori etil etil eterja, ch3Co2Pogl2Pogl3, in etanska kislina (ocetna kislina).
Praktično, kar se zgodi, je zamenjava vodika hidroksilne skupine s skupino Aquilus:
R1-OH => r1-OCOR2
V primeru (ch3Co)2Ali pa je vaša skupina acilo -coch3. Zato se reče, da je skupina OH podvržena akilaciji. Vendar akilacija in esterifikacija nista zamenljiva pojma; Akilacija se lahko pojavi neposredno v aromatičnem obroču, znanem kot akilacijsko ime Friedel-Crafts.
Tako alkoholi v prisotnosti kislinskih anhidridov esterificirajo z acilacijo.
Po drugi strani pa le ena od dveh kislinskih skupin reagira z alkoholom, druga pa ostane z vodikom, ki tvori karboksilno kislino; da v primeru (CHO3Co)2Ali pa je etanojska kislina.
Amidacija
Kisli anhidridi reagirajo z amonijakom ali amini (primarnimi in sekundarnimi), da sprožijo amide. Reakcija je zelo podobna na novo opisani esterifikaciji, vendar je ROH nadomeščen z aminom; Na primer sekundarna amina, r2Nh.
Spet reakcija med (ch3Co)2Ali in dietilamin, ET2NH:
(Pogl3Co)2O + 2et2Nh => ch3Nadaljevanje2 + Pogl3COO- +Nh2Et2
In nastajata dietilacetamid, CHO3Nadaljevanje2, in karboksilirano amonijevo sol, cho3COO- +Nh2Et2.
Čeprav se enačba morda zdi nekoliko težko razumeti, je dovolj, da opazujemo, kako skupina -3 Zamenjajte h ET2NH za oblikovanje Amide:
Et2Nh => et2NCOCH3
Več kot amidacija je reakcija še vedno akilacija. Vse je povzeto v tej besedi; Tokrat amina trpi acilacijo in ne alkohola.
Kako so anhidridi?
Anorganski anhidridi nastanejo tako, da element reagiramo s kisikom. Če je element kovinski, se oblikuje osnovni kovinski oksid; In če je ne -metalni, nastane ne -metalni oksid ali kislina anhidrid.
Lahko vam služi: Clausius-Clapeyronova enačba: za kaj je, primeri, vajeZa organske anhidride je reakcija druga. Dve karboksilne kisline se ne moreta neposredno pridružiti, da bi sprostili vodo in tvorili anhidridno kislino; Udeležba spojine, ki še ni bila omenjena: acil klorid, RCOCL je potrebna.
Karboksilna kislina reagira s kislim kloridom in proizvaja ustrezen anhidrid in vodikov klorid:
R1COCL + R2Cooh => (r1Co) ali (cor2) + HCl
Pogl3Cocl + ch3Cooh => (cho3Co)2O + hcl
A ch3 prihaja iz acetilne skupine, CHO3Co-, drugi pa je že prisoten v ocetni kislini. Izbira specifičnega kislinskega klorida in karboksilne kisline lahko povzroči sintezo simetrične ali asimetrične kisline.
Ciklični anhidridi
Za razliko od drugih karboksilnih kislin, ki zahtevajo kisli klorid, se lahko dikarboksilne kisline v ustreznem anhidridu kondenzirajo. Če želite to narediti, jih je treba ogrevati, da se spodbudi sproščanje h2Tudi. Na primer, tvorba ftaličnega anhidrida je prikazana iz fotolske kisline.
 Ftalična tvorba anhidridov. Vir: Jü [Public Domain], iz Wikimedia Commons
Ftalična tvorba anhidridov. Vir: Jü [Public Domain], iz Wikimedia Commons Upoštevajte, kako je peteganski obroč dokončan, in kisik, ki se pridruži obema skupinama c = o, je del tega; To je ciklični anhidrid. Vidimo tudi, da je ftalni anhidrid simetrični anhidrid, saj toliko r1 kot r2 So enaki: aromatičen prstan.
Niso vse dikarboksilne kisline sposobne oblikovati svoj anhidrid, saj so, ko so njihove skupine COOH zelo ločene, prisiljene dokončati vse večje obroče. Največji obroč, ki ga je mogoče oblikovati, je šesterokotni, večji od tega, da reakcija ne poteka.
Nomenklatura
Kako se imenujejo anhidridi? Če pustite ob strani anorgansko, pomembne za vprašanja oksida, so imena organskih anhidridov doslej pojasnjena odvisna od identitete r1 in r2; to je od njenih acilnih skupin.
Če sta dva R enaka, je dovolj, da besedo "kislina" zamenjate z "anhidridom" v ustreznem imenu karboksilne kisline. In če sta nasprotno, dva R sta drugačna, sta poimenovana po abecednem vrstnem redu. Zato morate najprej videti, če gre za simetrični ali asimetrični anhidrid.
Pogl3Co)2Ali je simetričen, saj je r1= R2 = Pogl3. Izhaja iz ocetne ali etanojske kisline, zato je njegovo ime po prejšnji razlagi: ocetni ali etanočni anhidrid. Enako se zgodi s pravkar omenjenim ftaličnim anhidridom.
Recimo, da imate naslednji anhidrid:
Pogl3Co (o) coch2Pogl2Pogl2Pogl2Pogl2Pogl3
Acetilna skupina na levi prihaja iz ocetne kisline, na desni pa iz heptanske kisline. Če želite poimenovati ta anhidrid. Torej, njegovo ime je: heptanoični ocetni anhidrid.
Prijave
Anorganski anhidridi imajo neskončno uporabo, od sinteze in formulacije materialov, keramike, katalizatorjev, cementov, elektrod, gnojil itd., Dokler se s svojimi tisočimi železnimi in aluminijastimi minerali in ogljikovim dioksidom izdihajo živa organizma.
Vam lahko služi: DeCantation: koncept, primeri in vrstePredstavljajo izhodiščni vir, točko, kjer izhaja veliko spojin, ki se uporabljajo v anorganski sintezi. Eden najpomembnejših anhidridov je karbonski, co2. Je skupaj z vodo bistvenega pomena za fotosintezo. In na industrijski ravni3 Ključnega pomena je, saj iz nje dobimo obtoženca žveplove kisline.
Morda je anhidrid z več aplikacijami in za (dokler je življenje) eden iz fosforne kisline: adenozin triposfat, bolj znan kot ATP, prisoten v DNK in "energetska valuta" presnove.
Organski anhidridi
Kisli anhidridi reagirajo z acilacijo, bodisi na alkohol, ki tvorijo ester, amin, kar povzroča amido ali aromatični obroč.
Vsake od teh spojin je na milijone in sto tisoč možnosti karboksilne kisline za pripravo anhidrida; Zato sintetične možnosti drastično rastejo.
Tako je ena glavnih aplikacij vključiti kislinsko skupino v spojino, ki nadomešča enega od atomov ali skupin njegove strukture.
Vsak dioksid ima ločeno svoje aplikacije, na splošno pa vsi reagirajo na podoben način. Zaradi tega se te vrste spojin uporabljajo za spreminjanje polimernih struktur, ustvarjanje novih polimerov; to je kopolimeri, smole, prevleke itd.
Na primer, ocetni anhidrid se uporablja za acetilacijo vseh skupin celuloze OH (spodnja slika). S tem vsakega H OH nadomesti acetilna skupina, Coch3.
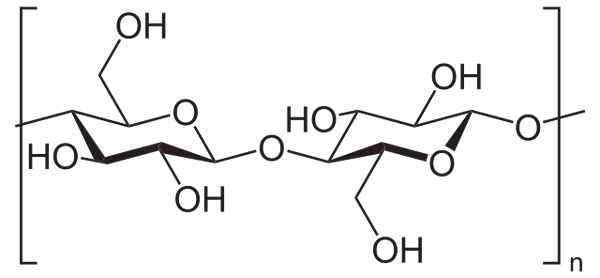 Celuloza. Vir: Neurotoger [Public Domain], iz Wikimedia Commons
Celuloza. Vir: Neurotoger [Public Domain], iz Wikimedia Commons Na ta način dobimo celulozni acetatni polimer. Enako reakcijo lahko skiciramo z drugimi polimernimi strukturami s skupinami NH2, Tudi dovzetna za acilacijo.
Te akilacijske reakcije so koristne tudi za sintezo zdravil, kot je aspirin (kislina acetilsalicil).
Primeri
Pokazano je, da zaključijo še nekaj drugih primerov organskih anhidrijev. Čeprav jih ne bodo omenili, lahko kisikove atome nadomestimo z žveplom, kar daje sulfurizirane anhidride ali celo fosfor.
-C6H5Co (o) kuhar6H5: Benzoični anhidrid. Skupina c6H5 predstavlja benzenski obroč. Njegova hidroliza proizvaja dve benzojski kislini.
-HCO (O) COH: Formic Anhidrid. Njegova hidroliza daje dve mravljični kislini.
- C6H5Co (o) coch2Pogl3: Propanoični benzoični anhidrid. Njegova hidroliza proizvaja benzojske in propanske kisline.
-C6HenajstCo (o) kuhar6Henajst: Cikloheksanokroboksilicana anhidrid. Za razliko od aromatičnih obročev so ti nasičeni, brez dvojnih povezav.
-Pogl3Pogl2Pogl2Co (o) coch2Pogl3: Propanoični butanski anhidrid.
Sukcinični anhidrid
 Sukcinični anhidrid. Vir: Ninjatacoshell [Public Domain], iz Wikimedia Commons
Sukcinični anhidrid. Vir: Ninjatacoshell [Public Domain], iz Wikimedia Commons Tu imate še eno ciklično, pridobljeno iz sukcinske kisline, dikarboksilne kisline. Opomba, kot trije atomi kisika izdajajo kemično naravo te vrste spojine.
Anhidrid Maleico je zelo podoben kot pri sukciniku, z razliko, da obstaja dvojna vez med ogljikovo.
Glutarijski anhidrid
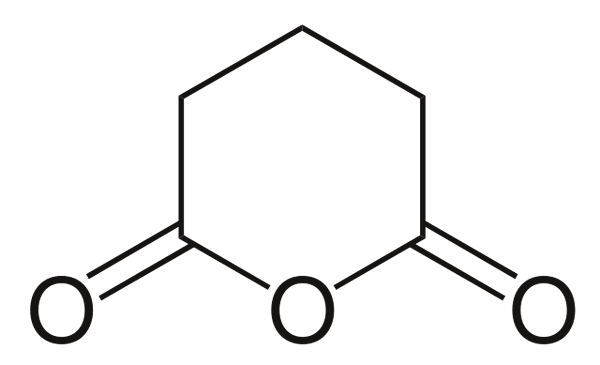 Glutarijski anhidrid. Vir: Choij [Public Domain], iz Wikimedia Commons
Glutarijski anhidrid. Vir: Choij [Public Domain], iz Wikimedia Commons In končno je prikazan anhidrid glutarične kisline. To strukturno razlikuje vse druge s tem, da je sestavljen iz šesterokotnega obroča. Spet trije atomi kisika izstopajo v strukturi.
Trije atomi kisika lahko vedno dokazujejo druge bolj zapletene anhidride, ki so zelo blizu drug drugemu.
Reference
- Anhidrid. ENCLYCLOPAEDIA Britannica. Okrevano od: Britannica.com
- Opredelitev kisle anhidrida v kemiji. Okreval od: Thoughtco.com

