Amfoterji, ki so, vrste in primeri
- 1477
- 210
- Percy Feeney
The Amfoste So spojine ali ioni, ki imajo posebnost, da se lahko obnašajo kot kislina ali kot baza, v skladu s teorijo Bronsted in Lowry. Njegovo ime izvira iz grške besede Amfoteroi, kar pomeni "oboje".
Številne kovine tvorijo amfoteros okside ali hidrokside, vključno z bakrom, cinkom, kositrom, svincem, aluminijem in berilijem. Amfoter, značilen za te okside, je odvisna od stanja oksidacije zadevnega oksida. Na koncu članka so vključeni primeri teh snovi.

Kovinski oksidi, ki lahko reagirajo s kislinami in bazami za proizvodnjo soli in vode, so znani kot amfoteros oksidi. Svinčni in cinkovi oksidi so zelo dobri primeri, med drugimi spojinami.
[TOC]
Kaj so amfoter?
Glede na teorijo Bronsted in Lowryjeve kisline so kisline tiste snovi, ki donirajo protone, medtem ko so baze tiste, ki sprejemajo ali jemljejo protone.
Molekula, imenovana amfotat.
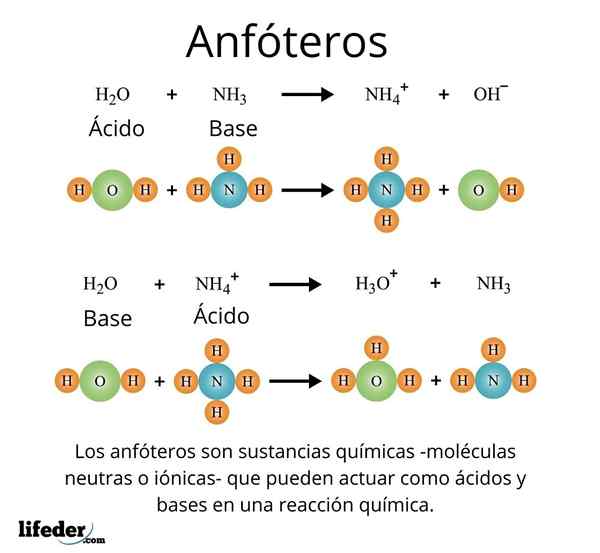
Pomemben in dobro prepoznaven primer je univerzalno topilo, voda (h₂o). Ta snov zlahka reagira s kislinami, na primer v reakciji s klorovodikovo kislino:
H2O + hcl → h3Tudi+ + Cl-
Toda tudi on nima težav, da bi reagiral z bazo, kot v primeru amoniaka:
H2O + nh3 → NH4 + Oh-
S temi primeri je mogoče opaziti, da voda deluje v celoti kot amfotatna snov.
Vrste amfoterjev
Čeprav so amftentne snovi lahko molekule ali ioni, obstajajo molekule, ki najbolje prikazujejo amfotentne značilnosti in pomagajo bolje preučiti to vedenje: amfrofrotične snovi. To so molekule, ki lahko posebej podarijo ali sprejmejo proton, da delujejo kot kislina ali baza.
Vam lahko služi: rodio: zgodovina, lastnosti, struktura, uporabe, tveganjePojasniti je treba, da so vse amfotične snovi amfotične, vendar niso vsi amfoterji amfiprtični; Obstajajo amfotoroji, ki nimajo protonov, vendar se lahko obnašajo kot kisline ali baze na druge načine (kot je Lewisova teorija).
Med amfiprtičnimi snovmi so ioni voda, aminokisline in bikarbonat in sulfatni. Amfrofotične snovi so posledično podklasificirane tudi glede na njihovo sposobnost darovanja ali donosa protonov:
Snovi protogene ali amfifiprine kisline
So tisti, ki imajo večjo težnjo po dajanju protona kot sprejemanja. Med njimi je žveplova kislina (h2SW4) in ocetna kislina (CHO3COOH), med drugim.
Osnovne protofilne ali amfotične snovi
So tisti, za katere lahko sprejmejo proton. Med temi snovmi najdete amoniak (NH3) in etilendiamid [c2H4(NH2)2].
Nevtralne snovi
Imajo enako lahkoto ali sposobnost sprejemanja protona, da se mu odrečejo. Med njimi je voda (h2O) in manjši alkoholi (-Roh), predvsem.
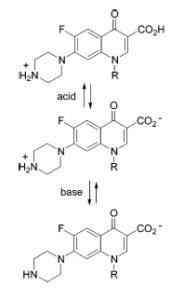 Ampotero lik kinolonov
Ampotero lik kinolonov Primeri amfotentnih snovi
 Napetost amfotero
Napetost amfotero Zdaj ste že opisali amfotentne snovi, ki jih je treba označiti za primere reakcij, v katerih so predstavljene te značilnosti.
Ion ogljikove kisline predstavlja osnovni primer amfiprtične snovi; Potem so njihove reakcije predstavljene, ko delujejo kot kislina:
HCO3- + Oh- → co32- + H2Tudi
Naslednja reakcija se pojavi, ko deluje kot osnova:
HCO3- + H3Tudi+ → H2Co3
Obstaja tudi veliko drugih snovi. Od teh so naslednji primeri:
Amfoteros oksidi
Cinkov oksid, kot že omenjeno. Nato je dokazano, zakaj.
Vam lahko služi: Justus von LiebigObnašanje kot kislina:
ZnO + H2SW4 → Znso4 + H2Tudi
Obnašanje kot baza:
ZnO + 2naOH + H2O → na2[Zn (OH)4]
Svinčni oksid (PBO), aluminij (Al2Tudi3) in kositer (sno) imata tudi svoje amfotentne značilnosti:
Obnaša se kot kisline:
PBO + 2HCl → PBCL2 + H2Tudi
Do2Tudi3 + 6HCl → 2alcl3 + 3H2Tudi
Sno + hcl ↔ sncl + h2Tudi
In kot baze:
PBO + 2naOH + H2O → na2[PB (OH)4]
Do2Tudi3 + 2naOH + 3H2O → 2na [al (OH)4]
Sno + 4naOH + h2Ali ↔ na4[Sn (OH)6]
Obstajajo tudi amfoteroski oksidi iz Galije, Indijca, Scandio, Titanija, Cirkonika, Vanadija, kroma, železa, kobalta, bakra, srebra, zlata, germanio, antimona, bizmuthu in telurio.
Anfoter hidroksidi
Hidroksidi lahko predstavljajo tudi amfotentne značilnosti, na primer v primerih aluminijevega hidroksida in berilija. Oba primera opazita spodaj:
Aluminijev hidroksid kot kislina:
Al (OH)3 + 3HCl → ALCL3 + 3H2Tudi
Aluminijev hidroksid kot baza:
Al (OH)3 + NaOH → NA [AL (OH)4]
Berlijev hidroksid kot kislina:
Biti (oh)2 + 2HCl → Becl2 + H2Tudi
Berlijev hidroksid kot baza:
Biti (oh)2 + 2naOH → NA2[Biti (OH)4]
Razlike med amfoterosi, amfiprtiki, amfoliti in apriciki
Treba je vedeti, kako razlikovati koncept vsakega izraza, saj lahko njegova podobnost postane zmedena.
Znano je, da so amfotorosi snovi, ki se v reakciji obnašajo kot kisline ali baze, ki proizvajajo sol in vodo. To lahko storijo za donacijo ali zajemanje protona ali preprosto s sprejemanjem elektronskega navora (ali dati) v skladu s teorijo Lewisove teorije.
Po drugi strani so amfotične snovi tiste amfoterji, ki z darovanjem ali zbiranjem protona delujejo kot kisline ali baze, po zakonu Bronsted-Lowry. Vse amfotične snovi so amfotične.
Vam lahko služi: benzoine: struktura, lastnosti, uporabe in tveganjaAmpolitne spojine so amfotentne molekule, ki obstajajo kot zwitterions in imajo dipolne ione v določenih phyeh pH. Uporabljajo se kot sredstva za dušenje v varovalnih rešitvah.
Končno so topila za stiskanje tista, ki nimajo protonov, ki bi jih lahko popustili in jih tudi ne morejo sprejeti.
Reference
- Amfoterni. (2008). Wikipedija. Pridobljeno iz in.Wikipedija.org
- Anne Marie Helmerine, P. (2017). Kaj pomeni amfoterično v kemiji?. Pridobljeno od Musicco.com
- Bicpuc. (2016). Amfoterične spojine. Pridobljeno iz meduma.com
- Kemikool. (s.F.). Opredelitev amfoterika. Pridobljeno iz Chemicool.com.
- « Najbolj priljubljena tipična Kolumbija
- Izbira teme raziskav, kako je pomena, primeri so narejeni »

