Ogljikovi alotropi
- 2779
- 632
- Mr. Shane Larkin
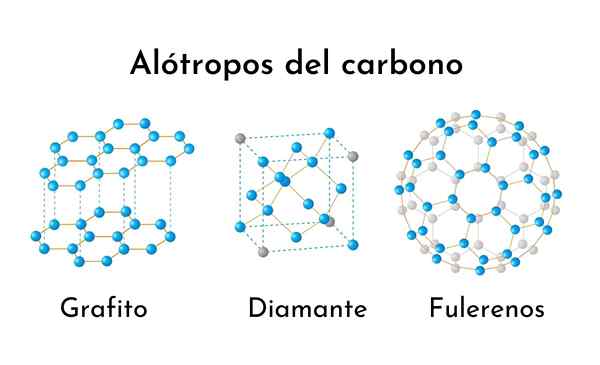
 Tri najpogostejše ogljikove alotrope
Tri najpogostejše ogljikove alotrope Kaj so ogljikovi alotropi?
Alotropna beseda se nanaša na različne molekularne oblike, v katerih je mogoče predstaviti kemični element. Zato so ogljikovi alotropi vse oblike, naravne ali ne, saj je mogoče predstaviti čisti ogljikov element.
Kljub temu, da ima popolnoma enako sestavo, imajo lahko alotropi popolnoma drugačne lastnosti.
To je še posebej razvpito v primeru ogljikovih alotropov. Kot bomo videli kasneje, eden od alotropov, diamant, tvori popolnoma prozorne in neverjetno trde kristale, druge pa so mehke in krhke snovi.
Nato so do zdaj opisani vsi ogljikovi alotrops, skupaj z njihovimi najbolj izjemnimi lastnostmi in njihovimi aplikacijami:
Diamant
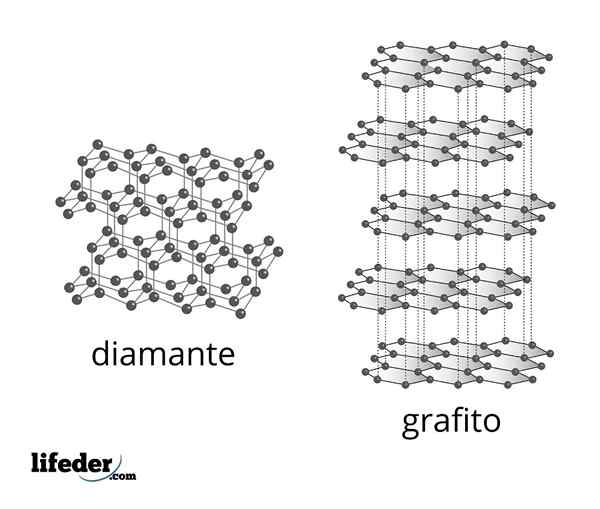 Mikroskopska struktura diamanta in grafita
Mikroskopska struktura diamanta in grafita Diamant je najbolj stabilna oblika ogljika in je ena izmed dveh najbolj znanih alotropov tega elementa. Sestavljen je iz tetraedrskih ogljikovih atomov s hibridizacijo SP3 Povezane s preprostimi C-C kovalentnimi vezmi v tridimenzionalnem kovalentnem omrežju.
Ta ogljikov alotrop je naravno ali ga je mogoče izdelati iz grafita z visokimi pritiski.
Lastnosti
- Sestavljen je iz prozorne in brezbarvne kristalne trdne snovi, ki jo je mogoče polirati pri visoki svetlosti.
- Je najtežji mineral, ki ga pozna človek. To pomeni, da lahko diamant opraska površino katerega koli drugega materiala in ga je mogoče opraskati le z drugim diamantom.
- Je eden najdražjih naravnih elementov na svetu.
- To je najboljši toplotni prevodnik, ki je znan s toplotno prevodnostjo med 1300 in 2300 w/m.K.
- Ne izvaja električne energije.
- Ima zelo nizek koeficient toplotne ekspanzije.
- Ima zelo nizko koeficient trenja.
Prijave
- Njegova najbolj znana vsakodnevna uporaba je v nakitu.
- Zaradi svoje trdote je odličen abrazivni material, zato ga dodamo na površino rezanja in poliranja instrumentov kovin, kamnin itd.
- Zaradi toplotnih lastnosti se uporablja pri proizvodnji toplotnih disipatorjev.
- Uporablja se pri izdelavi mikro ležajev z nizkim trenjem.
Grafit
Je še ena najbolj znanih ogljikovih alotropov. To je zelo pogost material, ki ima strukturo, ki jo tvorijo listi ogljikovih atomov, zloženih na drugo.
Vsi atomi ogljika v grafitu imajo hibridizacijo SP2, Torej imajo ravno trigonalno strukturo. Vsak ogljik je povezan s tremi drugimi sosednjimi ogljiki, ki tvorijo šestnajstice, podobne benzenu, z elektronskim sistemom PI, ki je demociran na površini vsakega lista, zaradi česar je grafitna elektrika električna energija.
Lastnosti
- Je trden črni material pri sobni temperaturi.
- To je gorivo, zato lahko goriš v prisotnosti kisika.
- Grafit je dober električni prevodnik.
- Ima visoko tališče.
- To je mehak material, ki daje vtis, da je spolzka.
- Ima nizko koeficient trenja.
- Je dober toplotni prevodnik.
Prijave
- Pogosto se uporablja pri izdelavi svinčnikov za pisanje ali risanje.
- Pogosto se uporablja kot suho mazivo.
- Zaradi svoje električne prevodnosti in nizke kemične reaktivnosti se pogosto uporablja pri električnih stikih v različnih elektronskih napravah.
- Uporablja se v elektrodah za kemijsko analizo.
Grafen
 Grafenska struktura
Grafenska struktura Grafen ni nič drugega kot list izoliranega grafita. Opredeljen je kot dvodimenzionalni kristal in ga dobimo z ločevanjem grafitnih plasti z lepilnim trakom. Graphene ima edinstvene lastnosti, ki ga razlikujejo od grafita, kljub podobni strukturi.
Vam lahko postreže: Zakon o pivuLastnosti
- Visoka električna in toplotna prevodnost.
- Je elastičen in prožen material, a hkrati z visoko trdoto in odpornostjo.
- Za eno debelino atoma ogljika je popolnoma prozoren material.
- Lahko proizvede elektriko z izpostavljenostjo sončni svetlobi.
Prijave
- Prilagodljivi zasloni.
- Prilagodljiva elektronska vezja.
- Antikorozivne prevleke.
- Zelo učinkovite sončne panele.
- Sistemi za sekvenciranje DNK.
- Biosenzorji z visoko natančnostjo.
Fantje ali nanokarbon
Fantje so zaprte molekularne strukture, ki jih tvorijo samo ogljikovi atomi, v katerih so predstavljeni v obliki obročev od 4 do 7 članov.
Odvisno od njihove velikosti in oblike se običajno razlikuje več vrst fantov:
Buckminsterjane (c60)
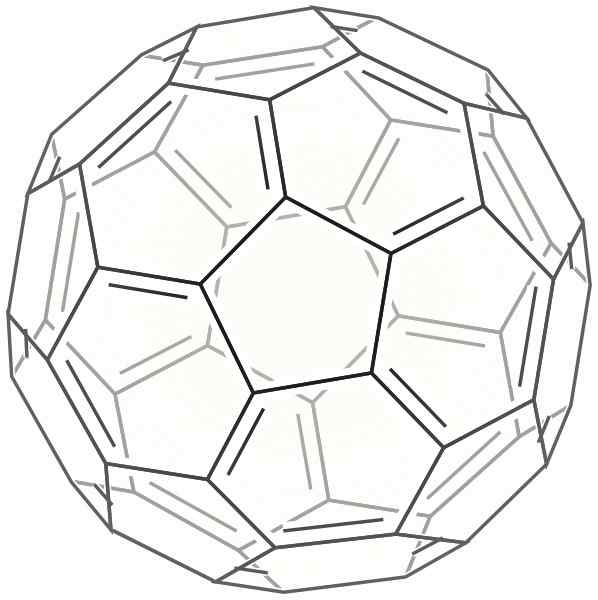 2d buckminsterja okostja
2d buckminsterja okostja Ta je oblikovana kot krogla, ki je zelo podobna nogometni žogi. Imenuje se tudi Bucky Ball.
Lastnosti
- Visoka električna in toplotna prevodnost
- Odpornost z visoko napetostjo.
- Tvorijo zelo duktilen material.
- So relativno inertni do kemijskih reakcij.
Prijave
- Protivirus
- Antioksidanti
- Sistemi za dajanje zdravil
Ogljikove nanocevke
 Struktura ogljikovega nanotubusa, v kateri so vsi atomi ogljika združeni z ne -polarnimi kovalentnimi vezmi
Struktura ogljikovega nanotubusa, v kateri so vsi atomi ogljika združeni z ne -polarnimi kovalentnimi vezmi Ti tvorijo bazo in začetek nanotehnologije. So dolgi udarci s cevasto obliko in so danes eden najbolj preučenih materialov z neštetimi aplikacijami njihovih edinstvenih lastnosti.
Lastnosti
Imajo enake osnovne lastnosti bucky kroglic, ko pa so podolgovate, so boljši vozniki električne energije v osni smeri.
Prijave
- V proizvodnji nanokomporenih materialov z edinstvenimi mehanskimi, toplotnimi in električnimi lastnostmi.
- Molekularni elektronski sistemi.
- Biosenzorji z visoko občutljivostjo.
- Sistemi za shranjevanje energije.
Grafenilen
Ta alotropni ima dvodimenzionalno stekleno strukturo, ki je zelo podobna grafenu, vendar jo tvorijo bifenilenske enote z obročki štirih članov, prepletenih med šestimi obroči, namesto da vsebuje samo šesterokotne aranžmaje.
Grafit aa '
To je ogljikova oblika, odkrita leta 2008. To je posebna vrsta grafita, ki se razlikuje le v načinu, kako so grafitni listi zloženi na drugega. To je metastabilna grafitna oblika, ki lahko razloži tvorbo in lastnosti nekaterih ogljikovih nanocevk več plasti.
Grafenilen
Graphenilen je nov nedavno odkrit karbonotropski. Sestavljeni iz dvodimenzionalne diamantne oblike, ki jo dobimo s stiskanjem grafita pri zelo visokih tlakih. To povzroča, da se grafitni listi med seboj povezujejo in tvorijo diamant le nekaj debelih ogljikovih atomov.
Amorfni ogljik
Na splošno je sestavljena iz mešanice različnih oblik ogljika v različnih razmerjih. Nanocevke lahko vsebujejo ali druge vrste fantov, grafita itd. Najdemo ga v naravnih vzorcih, kot sta mineral ali oglje, ki jih povzroča piroliza lesa.
Uporablja se predvsem kot gorivo pri ogrevanju, proizvodnji energije ali kuhanju hrane.
Pod steklavico
Gre za ogljikovo obliko, pridobljeno s segrevanjem nekaterih organskih predhodnikov pri visokih temperaturah. Je zelo odporen material pri visokih temperaturah in kemični napadi s kislino in kisikom. Je tudi neprepustno za pline.
- « 80 znanstvenih stavkov znanih znanstvenikov
- 100 utrujenih stavkov o življenju, ljubezni in sreči »

