Terciarna struktura alkohola, lastnosti, primeri
- 905
- 138
- Percy Feeney
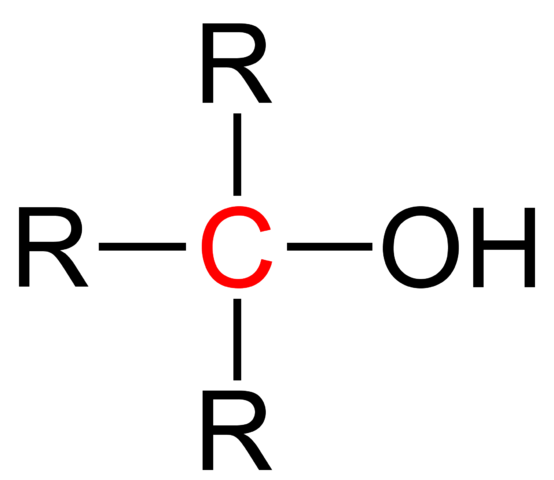
A Terciarni alkohol To je ena, v kateri je hidroksilna skupina, OH, povezana s terciarnim ogljikom. Njegova formula je še naprej ROH, kot drugi alkoholi; Vendar ga je enostavno prepoznati, ker je OH blizu X v molekularni strukturi. Tudi njegova gazirana veriga je običajno krajša, njegova glavna molekularna masa.
Potem je terciarni alkohol težji, bolj razvejan je in je tudi najmanj reaktiven glede na oksidacijo; to pomeni, da ga ni mogoče spremeniti v ceton ali karboksilno kislino, kot se pojavlja pri sekundarnih in primarnih alkoholih.
 Strukturna formula terciarnega alkohola. Vir: Jü [javna domena].
Strukturna formula terciarnega alkohola. Vir: Jü [javna domena]. Splošna strukturna formula za terciarni alkohol je prikazana na zgornji sliki. Po njenih besedah bi lahko napisali novo formulo R -tipa3Coh, kjer je R lahko alkilna ali arilna skupina; Skupina Metilo, ch3, ali kratko ali dolgo gazirano verigo.
Če so tri skupine R drugačne, bo osrednji ogljik terciarnega alkohola kiralno; to pomeni, da bo alkohol predstavil optično aktivnost. V tem dejstvu terciarni quiralni alkoholi zaračunavajo zanimanje v farmacevtski industriji, saj se iz ketonov z biološko aktivnostjo ti alkoholi sintetizirajo s bolj zapletenimi strukturami.
[TOC]
Struktura terciarnega alkohola
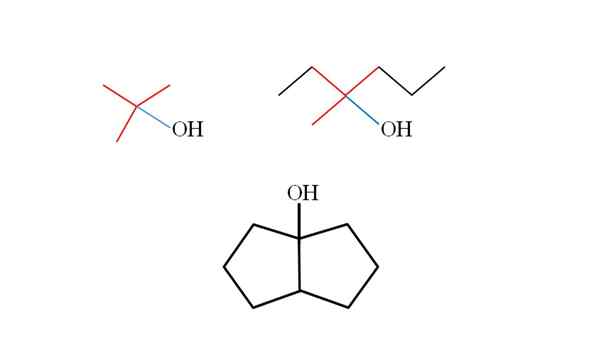 Trije terciarni alkoholi in njihove strukture. Vir: Gabriel Bolívar.
Trije terciarni alkoholi in njihove strukture. Vir: Gabriel Bolívar. Razmislite o strukturah zgornjih terciarnih alkoholov, da se jih naučite prepoznati ne glede na spojino. Ogljik, povezan z OH, mora biti tudi povezan s tremi drugimi ogljiki. Če ga podrobno opazimo, trije alkoholi upoštevajo to.
Prvi alkohol (na levi) je sestavljen iz treh skupin ch3 Central Carbon povezan, katere formula bi bila (CHO3)3Coh. Najemna skupina (izberite3)3C- znan je kot Tertbutil.
Lahko vam postreže: potenciometer (fameter)Drugi alkohol (na desni) ima osrednjo ogljikovo lin3, Pogl3Pogl2 in pogl2Pogl2Pogl3. Ker so tri skupine različne, je alkohol kiralen in ima zato optično aktivnost. Tu ne opazimo T, ampak x blizu OH (rdeča in modra).
In v tretjem alkoholu (spodaj in brez barv) je OH povezan z enim od dveh ogljikov, ki se pridružita dvema Cyclopentanoma. Ta alkohol ne predstavlja optične aktivnosti, ker sta dve osrednji skupini, povezani z ogljikom, enaki. Tako kot drugi alkohol, če ga skrbno opazimo, bo tudi X (raje tetraedron) najden.
Stericna ovira
Trije nadrejeni alkoholi imajo nekaj več skupnega kot X: centralni ogljik je sterično preprečen; Se pravi, v vesolju ga obdaja veliko atomov. Takojšnja posledica tega je, da nukleofili, željni pozitivnih obtožb, dobijo težave pri pristopu k temu ogljiku.
Po drugi strani, ki imajo tri ogljik, povezane s centralnim ogljikom, dajejo del elektronske gostote, ki jo elektronegativni atom kisika odšteje in ga še bolj stabilizira pred temi nukleofilnimi napadi. Vendar lahko terciarni alkohol trpi z nadomeščanjem z oblikovanjem karbokacije.
Lastnosti
Fizično
3. alkoholi na splošno predstavljajo zelo razvejane strukture. Prva posledica tega je, da je skupina OH preprečena, zato njegov dipolni trenutek manjši vpliv na sosednje molekule.
To pomeni šibkejše molekularne interakcije v primerjavi s primarnimi in sekundarnimi alkoholi.
Vam lahko služi: načelo Le ChâtelierNa primer, upoštevajte strukturne izomere butanola:
Pogl3Pogl2Pogl2Oh (n-Butanol, PEB = 117 ° C)
(Pogl3)2Pogl2OH (izobutilni alkohol, PEB = 107 ° C)
Pogl3Pogl2Ch (oh) ch3 (Sekbutilni alkohol, PEB = 98 ° C)
(Pogl3)3COH (tertbutilni alkohol, PEB = 82 ° C)
Upoštevajte, kako se vrelišča spuščajo, ko izomer postane bolj razvejan.
Sprva je bilo omenjeno, da v strukturah alkoholov 3 opazimo X, kar samo po sebi označuje visoko vejo. Zato imajo ti alkoholi nižje točke in/ali vrelišča.
Za vašo mešljivost z vodo je nekoliko podobno. Bolj kot preprečimo manj mešljiv OH, bo alkohol 3 z vodo. Vendar to mešljivost zmanjšuje dlje, karbonska veriga; Tako je toplotni alkohol bolj topen in mešan z vodo kot n-Butanol.
Kislost
Terciarni alkoholi so ponavadi najmanj kislin od vseh. Razlogi so številni in se med seboj nanašajo. Če povzamemo račune, negativna obremenitev njegovega izpeljanega alcoksida, rdeča-, Za tri alkalne skupine, povezane s centralnim ogljikom, boste začutili močno odboj.
Bolj kot nestabilen je anion, manj bo kislost alkohola.
Reaktivnost
3. alkoholi ne morejo trpeti oksidacij za ketone (r2C = o) ali aldehidos (rcho) ali karboksilne kisline (RCOOH). Po eni strani bi moral izgubiti enega ali dva ogljika (v obliki co2) oksidacijo, kar zmanjšuje reaktivnost proti oksidaciji; In na drugi strani nima vodika, ki lahko izgubi, da tvori drugo povezavo s kisikom.
Lahko vam služi: piridin: struktura, lastnosti, uporabe, strupenost, sintezaVendar lahko trpijo nadomestitev in izločanje (tvorba dvojne vezi, alkena ali olefina).
Nomenklatura
Nomenklatura za te alkohole ni drugačna kot pri drugih. Obstajajo običajna ali tradicionalna imena in sistematična imena, ki jih ureja IUPAC.
Če je glavna veriga in njegove posledice sestavljena iz priznane najemne skupine, se uporablja za svoje tradicionalno ime; Kadar tega ni mogoče, se uporablja nomenklatura IUPAC.
Na primer, razmislite o naslednjem terciarnem alkoholu:
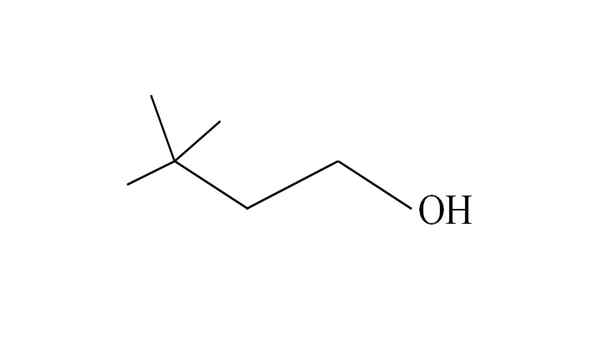 3.3-dimetil-1-butanol. Vir: Gabriel Bolívar.
3.3-dimetil-1-butanol. Vir: Gabriel Bolívar. Začne naštevati ogljikove ogljikove od desne proti levi. V C-3 sta dve skupini ch3 substituentov, zato je ime tega alkohola 3,3-dimetil-1-butanol (glavna veriga ima štiri ogljike).
Prav tako je celotna veriga in njene posledice sestavljena iz skupine neohexilo; Zato je njegovo tradicionalno ime lahko neoheksilni alkohol ali neoheksanol.
Primeri
Končno se omenja nekaj primerov terciarnih alkoholov:
-2-metil-2-propanol
-3-metil-3-heksanol
-Biciclo [3,3,0] Octan-1-ol
-2-metil-2-butanol: Ch3Pogl2Coh (pogl3)2
Formule prvih treh alkoholov so predstavljene na prvi sliki.
Reference
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. (5. izdaja). Uredništvo Addison-Wesley Interamerican.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Gunawardena Gamini. (31. januarja 2016). Terciarni alkohol. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Ashenhurst James. (16. junij 2010). Alkoholi (1) - nomenklatura in lastnosti. Okrevano od: mastersorganicChemistry.com
- Clark J. (2015). Uvajanje alkoholov. Okrevano od: Chemguide.co.Združeno kraljestvo
- Organska kemija. (s.F.). Tema 3. Alkoholi. [PDF]. Okreval od: Sinorg.Uji.je
- Nilanjana majumdar. (3. marec 2019). Sinteza kiralnega terciarnega alkohola: pomemben razvoj. Okrevano od: 2.Kemija.MSU.Edu
- « Formativno obdobje izvora Amerike, značilnosti, izdelkov
- Kako je bila evropska družba v prvi polovici devetnajstega stoletja »

