Sekundarni alkohol, kar je, struktura, lastnosti, uporablja
- 1991
- 105
- Miguel Gutmann DVM
Kaj je sekundarni alkohol?
A sekundarni alkohol Ima ogljikov ogljik hidroksilne skupine (OH), pritrjen na dva ogljika. Medtem je v primarnem alkoholu ogljikov ogljik hidroksilne skupine povezan z ogljikovim atomom in v terciarnem alkoholu, pritrjenem na tri ogljikove atome.
Alkoholi so nekoliko šibkejše kisline kot voda, z naslednjim PKA: voda (15,7); Metilni alkoholi (15,2), etil (16), izopropil (sekundarni alkohol, 17) in termični (18). Kot je razvidno, je izopropilni alkohol manj kisel kot metil in etilni alkoholi.
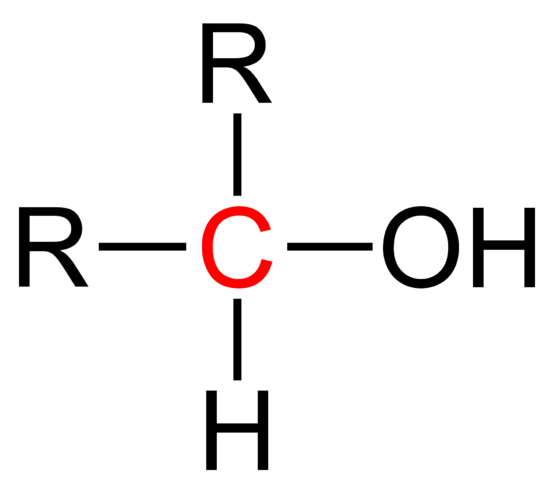
 Strukturna formula sekundarnega alkohola. Wikimedia Commons
Strukturna formula sekundarnega alkohola. Wikimedia Commons Na zgornji sliki je prikazana strukturna formula za sekundarni alkohol. Rdeči ogljik je nosilec OH in je povezan z dvema alkil (ali aril) R skupinama in enim atomom vodika.
Vsi alkoholi imajo generično formulo ROH; Če pa podrobno opazimo nosilec ogljika, potem dobimo primarni alkoholi (RCH2Oh), sekundarno (r2Choh, vzgojen tukaj) in terciarni (r3Coh). To dejstvo vpliva na njegove fizikalne lastnosti in reaktivnost.
Struktura sekundarnega alkohola
Alkoholne strukture so odvisne od narave R skupina. Vendar pa lahko za sekundarne alkohole naredimo nekatere zgledi, če upoštevamo, da lahko obstajajo samo linearne strukture z ali brez posledic ali ciklične strukture. Na primer, imate naslednjo sliko:
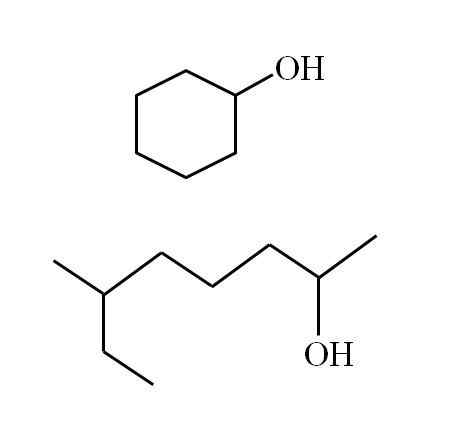 Ciklični sekundarni alkohol in druga razvejana veriga. Vir: Gabriel Bolívar
Ciklični sekundarni alkohol in druga razvejana veriga. Vir: Gabriel Bolívar Upoštevajte, da je za obe strukturi nekaj skupnega: oh je povezan z "V". Vsak konec V predstavlja enako skupino (zgornji del slike, ciklična struktura) ali drugačen (spodnji del, razvejana veriga).
Na ta način je vsak sekundarni alkohol zelo enostavno prepoznati, tudi če njegova nomenklatura sploh ni znana.
Lastnosti
Vrelišča
Lastnosti sekundarnih alkoholov se ne razlikujejo preveč od drugih alkoholov. Običajno so prozorne tekočine in da so trdni pri sobni temperaturi, mora oblikovati več vodikovih mostov in imeti visoko molekulsko maso.
Lahko vam služi: perbromska kislina (Hbro4): Lastnosti, tveganja in uporabeVendar pa enaka strukturna formula r2Choh predlaga določene edinstvene lastnosti na splošno za te alkohole. Na primer, skupina OH je manj izpostavljena in na voljo za interakcije vodikovih mostov, r2Ch-Oh-Ohchr2.
To je zato, ker lahko R skupine, ki mejijo na ogljik v avtomobilu, prinesete in ovirajo nastanek vodikovih mostov. Kot rezultat tega imajo sekundarni alkoholi nižje vrelišča kot primarna (RCH2OH).
Kislost
Po definiciji Brönsted-Lowry je kislina tista, ki podari protone ali vodikove ione, h+. Ko se to zgodi s sekundarnim alkoholom, imate:
R2Choh + b- => R2Cho- + Hb
Konjugat ras2Cho-, Alcoxide anion, vaša negativna obremenitev se mora stabilizirati. Za sekundarni alkohol je stabilizacija nižja, saj imata dve R -skupini elektronsko gostoto, kar do določene stopnje odbija negativno obremenitev atoma kisika.
Medtem za alkoksidni anion primarnega alkohola RCH2Tudi-, Manj je elektronskega odbojnosti, ki ima samo eno skupino R in ne dva. Poleg tega vodikovi atomi ne izvajajo pomembnih odbojnosti in nasprotno prispevajo k stabilizaciji negativne obremenitve.
Zato so sekundarni alkoholi manj kisli kot primarni alkoholi. Če je temu tako, potem so bolj osnovni in natančno iz istih razlogov:
R2Choh + h2B+ => R2Choh2+ + Hb
Zdaj R skupine stabilizirajo pozitivno obremenitev kisika z dajanjem dela njihove elektronske gostote.
Reakcije
Vodikov hallogenid in fosfor trihalogenid
Sekundarni alkohol lahko reagira z vodikovim halogenidom. Kemična enačba reakcije med izopropilnim alkoholom in bromerično kislino je prikazana na sredstvu žveplove kisline in proizvajajo izopropil bromid:
Pogl3Chohch3 + Hbr => ch3Chbrch3 + H2Tudi
In lahko reagirate tudi s trihalogenuero fosforja, px3 (X = br, i):
Lahko vam služi: nikelj hidroksid (III): struktura, lastnosti, uporabe, tveganjaPogl3-Choh-ch2-Pogl2-Pogl3 + Pbr3 => Ch3-chbr-ch2-Pogl2-Pogl3 + H3Po3
Kemikacija zgoraj ustreza reakciji med odsekom in fosforjevim tribromidom, kar povzroči SEC-Pentil Bromid.
Upoštevajte, da je v obeh reakcijah sekundarni alkil halogenid (R2Chx).
Dehidracija
V tej reakciji se izgubi H in OH sosednjih ogljikov, ki tvorita dvojno vez med tema dvema ogljikovih atomih. Zato obstaja tvorba alkena. Reakcija zahteva kisli katalizator in oskrbo s toploto.
Alkohol => alkene + h2Tudi
Na primer imate naslednjo reakcijo:
Cikloheksanol => CycloHexen + H2Tudi
Reakcija z aktivnimi kovinami
Sekundarni alkoholi lahko reagirajo s kovinami:
Pogl3-Choh-ch3 + K => cho3Cho-K+Pogl3 + ½ h+
Tu izopropilni alkohol reagira s kalijem, da tvori kalijev izoproksid in vodikove ione.
Esterifikacija
Sekundarni alkohol reagira s karboksilno kislino, da nastane ester. Na primer, kemična enačba reakcije kanhutilnega alkohola je prikazana z ocetno kislino, da nastane pol-butil acetat:
Pogl3Chohch2Pogl3 + Pogl3COOH CH3Coochch3Pogl2Pogl3
Oksidacija
Primarni alkoholi oksidirajo aldehido, ki oksidirajo karboksilne kisline. Toda sekundarni alkoholi oksidirajo aceton. Reakcije ponavadi katalizirajo kalijev dikromat (k2Cro7) in kromova kislina (h2Cro4).
Globalna reakcija je:
R2Choh => r2C = O
Nomenklatura
Sekundarni alkoholi so imenovani tako, da kažejo na položaj skupine OH v glavni verigi (daljši). Ta številka je pred imenom ali pa lahko po imenu ustreznega alkana za omenjeno verigo.
Na primer CHO3Pogl2Pogl2Pogl2Chohch3, To je 2-heksanol ali heksan-2-to.
Če je struktura ciklična, ni treba namestiti števca; razen če obstajajo drugi substituenti. Zato se ciklični alkohol druge slike imenuje cikloheksanol (prstan je šesterokotni).
Vam lahko služi: amineIn za drugi alkohol iste slike (razvejano) je ime: 6-etil-heptan-2 -ol.
Prijave
-Sec-butanol se uporablja kot topilo in vmesno kemikalijo. Prisoten je v hidravličnih tekočinah za zavore, industrijska čistila, poliranje, pinčenje, sredstva za mineralno flotacijo ter sadje in parfumske esence.
-Isopropanol alkohol se uporablja kot industrijsko topilo in kot antikoagulant. Uporablja se v oljih in hitro sušilnih črnilih, kot so antiseptik in nadomestek za kozmetični etanol (na primer: losjoni kože, kapilarni tonik in trenje alkohola).
-Isopropanol je sestavina tekočih mil, kristalnih čistil, sintetičnih aromatizatorjev brezalkoholnih pijač in hrane. Poleg tega je vmesna kemikalija.
-Cikloheksanol se uporablja kot topilo v tkivnem zaključku pri obdelavi usnja in emulgiranja mil ter sintetičnih detergentov.
-Metilcicloheksanol je sestavina izdelkov za žvečenje, ki temelji na milu in detergentih za posebna tkiva.
Primeri
2-oktanol
 Molekula 2-Ortanol. Vir: Jü [Public Domain], iz Wikimedia Commons
Molekula 2-Ortanol. Vir: Jü [Public Domain], iz Wikimedia Commons To je maščobni alkohol. Je brezbarvna tekočina, malo topna v vodi, vendar topna v večini ne -polarnih topil. Med drugim se uporablja pri izdelavi okusov in dišav, slik in premazov, črnil, lepil, gospodinjskih oskrbe in maziva.
Estradiol ali 17β-Stradiol
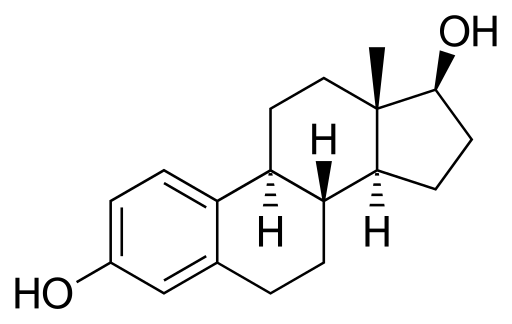 Molekula estradiola. Vir: Neurotoger [Public Domain], iz Wikimedia Commons
Molekula estradiola. Vir: Neurotoger [Public Domain], iz Wikimedia Commons To je steroidni seksualni hormon. V svoji strukturi ima dve skupini hidroksillov. To je prevladujoči estrogen v reproduktivnih letih.
20-hidroksi-levkotrien
To je presnovek, ki verjetno izvira iz oksidacije levkotrijskega lipida. Uvrščen je kot levkotrien cistinil. Te spojine so mediatorji vnetnega procesa, ki prispeva k patofiziološkim značilnostim alergijskega rinitisa.
2-heptanol
To je alkohol, ki ga najdemo v sadju. Poleg tega ga najdemo v ingverjevem olju in jagodah. Je prozorna, brezbarvna in netopna v vodi. Uporablja se kot topilo več smol in se vmeša v fazo flotacije pri predelavi mineralov.
Reference
- Enciklopedija zdravja in varnosti pri delu. (s.F.). Alkoholi. [PDF]. Okrevano od: INSHT.je
- Struktura in razvrstitev alkoholov. Kemija librettexts. Okrevano od: kem.Librettexts.org

