Struktura etilnega alkohola, lastnosti, uporabe, pridobivanje
- 1780
- 518
- Roman Schamberger
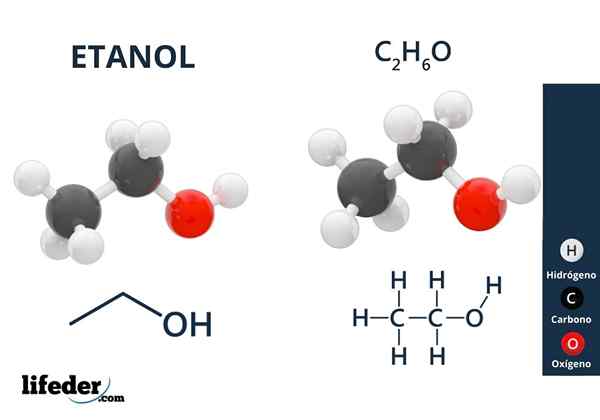
On Etilni alkohol ali etanol To je organska spojina, katere formula je c2H5Oh ali ch3Pogl2Oh, predstavljanje kot brezbarvna tekočina. To je drugi najpreprostejši primarni alkohol po metanolu. Je zelo topen v vodi in v mnogih organskih topilih, kar je omogočilo razvoj številnih njegovih aplikacij.
Ta alkohol je bil poleg uporabe pri sintezi zdravil in drugih organskih kemikalij uporabljen kot antiseptik in razkužilo, poleg uporabe pri sintezi zdravil in drugih organskih kemikalij. Uporablja se tudi kot gorivo v grelniku, svetilkah in v kombinaciji z bencinom v motornih vozilih.

Fermentacija sladkorja za proizvodnjo etanola je ena prvih kemičnih reakcij, ki se jih je naučil primitivni človek. Na Kitajskem je bila najdena 9000 -letna keramika.
Toda fermentacija sladkorja je povzročila le zelo nizko koncentracijsko raztopino etanola, zato se je bilo treba učiti tehnike destilacije za odpravo vode in koncentriranje alkohola. Tako so grški alkimisti, ki so delali v Aleksandriji v 1. stoletju.C., Že so vedeli in uporabljali destilacijo.
Vendar obstajajo sintetične poti, ki omogočajo pridobivanje popolnoma čistega etanola na podlagi etilena, ki je destiliran iz olja. Zato je olje posredni vir etanola. Na ta način dobimo etanol ali absolutni alkohol.
[TOC]
Struktura etilnega alkohola
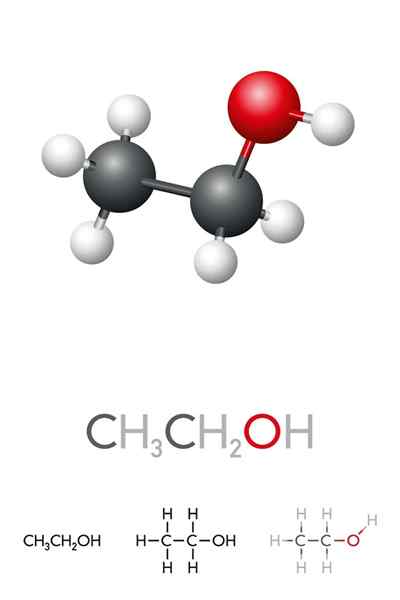
Na vrhunski sliki imamo molekularno strukturo etanola, CHO3-Pogl2-Oh, predstavljen s celotnim vesoljskim modelom. Je precej polarni molekularni, saj skupina OH privablja elektronsko gostoto do sebe iz ogljikovega okostja, na katerega je povezana.
Kot rezultat3Pogl2Oh-Ohch2Pogl3. Zato ima ta alkohol visoko vrelišče v primerjavi z drugimi organskimi topili ali tekočinami.
Lastnosti
Fizični videz
Brezbarvna tekočina.
Molarna masa
46.069 g/mol
Vonj
Mehek vonj in podoben vinu.
Okus
Gorijo.
Gostota
0.789 g/cm3 pri 20 ° C
Tališče
- 114,14 ° C
Vrelišče
78,24 ° C
Topnost vode
1 · 106 mg/l. To pomeni, da je praktično mehko v vseh razmerjih.
Mešljivost z organskimi topili
Etanol je mešan z ocetno kislino, acetonom, benzenom, ogljikovim tetrakloridom, kloroformom, dietičnim etrom, etilen glikolom, glicerolom, piridinom in toluenom. Zmest je tudi z lahkimi alifatskimi ogljikovodiki, kot sta Pentano in Hexano.
Koeficient oktanola/vode
Dnevnik p = - 0.31
Parni tlak
59.3 mm Hg pri 25 ° C. Zato je zavrnil zaznavno količino hlapov.
Vam lahko služi: barijev klorid (bacl2)Gostota hlapov
1.59 v zračnem razmerju, ki je vzeta kot enota (1)
točka vžiga
13 ° C
Temperatura samostojnosti
363 ° C
Toplota zgorevanja
1336.8 kJ/mol A 25 ° C
Izgorevanje
Etanol je hlapna tekočina, ki gori z modrim plamenom, brez dima, in to je praktično nevidno za naravno svetlobo.
Specifična toplota
0.618 apno/g pri 23 ° C
Goo
1.2 MPA · S pri 20 ° C
Indeks loma ηd
1.3611
Uporaba etilnega alkohola
 Ena najpogostejših uporabe alkohola je kot antiseptik
Ena najpogostejših uporabe alkohola je kot antiseptik Medicinske uporabe
Antiseptik
Etanol se uporablja kot antiseptik, saj ima smrtonosno delovanje proti bakterijam in glivam. Sposoben je spremeniti strukturo svojih plazemskih membran, ki povzroči njegovo uničenje skozi osmotske tokove, ki so vzpostavljeni.
Prav tako lahko etanol uniči številne vrste virusov. Trenutno je priporočljiva uporaba gelov, ki vsebujejo alkohol za razkuževanje rok in zmanjšanje okužbe s koronavirusom. Etanol se uporablja tudi pri dezinfekciji površnih manjših ran.
Topilo za droge
Številna zdravila so v vodi malo topna, pri čemer uporabljajo etanol za povečanje njihove topnosti. Nekateri čaji za izpiranje kašlja in ust imajo etanol, ki je do 25%.
Zdravljenje bolečine
Etanol se uporablja za terapevtsko lizo živcev ali ganglij za lajšanje kronične nerešljive bolečine, prisotne pri neoperabilnem raku ali v trigeminalni nevralgiji.
Simptomatsko zdravljenje s cistami ščitnice
Perkutane injekcije etanola se uporabljajo pri zdravljenju ščitničnih cist, kar je preprost postopek, ki bi se lahko izognil zapletom kirurškega posega.
Sedativno dejanje
Občasno se etanol intravensko daje za predoperativno in pooperativno sedacijo, pri tistih bolnikih, ki jim drugi ukrepi niso uporabni.
Protistrup
Etanol se uporablja za zdravljenje zastrupitve z metanolom ali etilen glikolom.
Glavkom
Etanol se uporablja za zmanjšanje intraokularnega tlaka pri bolnikih z glavkomom.
Gorivo
ZDA skupaj z Brazilijo porabijo 90% etanola, ki se uporablja kot gorivo v avtomobilih. ZDA so največji proizvajalec koruze na svetu, zato koruzo uporablja kot vir etanola kot gorivo.
Vlada je subvencionirala pridelovalce koruze, ki se je med letoma 1979 in 1986 povečala za proizvodnjo goriva v višini 20 milijonov litrov na leto na 750 milijonov litrov.
Sladkorna trsa je glavni vir etanola v Braziliji za uporabo kot gorivo. Leta 1943 zaradi druge svetovne vojne.
Vam lahko služi: deuteriumOd leta 1976 se uporabljajo kot gorivo v mešanici avtomobilov etanola in bencina, katerih vsebnost etanola se giblje med 10 in 25 %, odvisno od proizvodnje sladkornega trsa.
Rekreativna uporaba
Etanol je prisoten v številnih pijačah, ki se uporabljajo na družabnih srečanjih in celo med kosilom in družinsko večerjo.
Začetno dejanje alkohola za razkuževanje družbenega vedenja osebe ustvarja prijetno in olajšujoče okolje interakcije med ljudmi. Vendar lahko presežni etanol eksplodira strupene in nezaželene učinke na osebno zdravje in v harmoniji med sestanki ali dogodki.
Osebna nega
Etanol je prisoten v številnih kozmetiki in lepotnih izdelkih. Poleg tega se zaradi adstrigentnega delovanja uporablja pri čiščenju kože, odpravljanja maščob in umazanih ostankov, ki tega ne počnejo voda in milo. Je tudi del priprave številnih losjonov in parfumov.
Hrana
Bistvo vanilije, okus uporabe tort in tort, se raztopi v mešanici etanola in vode. Vodji, napolnjeni z določenimi alkoholnimi pijačami, se prodajajo. Alkohol se uporablja tudi kot okus nekaterih sladkarij.
Pridobivanje etilnega alkohola
Etanol dobimo predvsem s fermentacijo sladkorja in hidracijo etilena, ki vadi, da ga ustvarijo iz ogljikovega dioksida, lipidov in celuloze.
Fermentacija
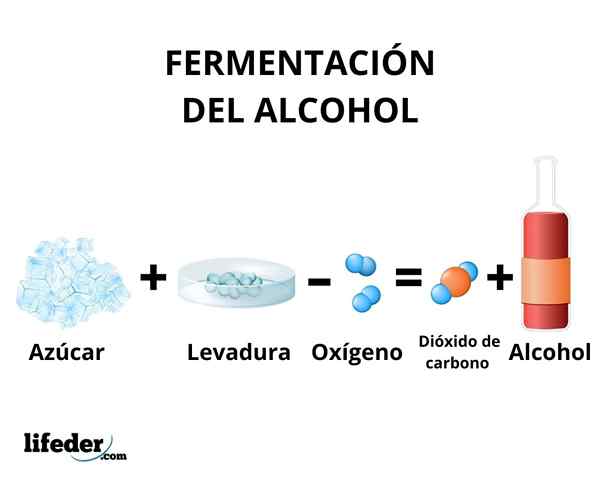
V procesu fermentacije se transformacija ogljikovih hidratov v etanolu zgodi z delovanjem encimov, ki so prisotni v kvasu. V glavnem se kot surovina uporabljajo sladkorni trs, pesa in žita, kot sta koruza in ječmen.
Encimi glikolize nekaterih vrst kvasovk, kot so Saccharomyces cerevisiae, Lahko delujejo na sladkor glukoze in saharoze, da bi ustvarili etanol. Koncentracija proizvedenega etanola je omejena s dovzetnostjo kvasovk na etanol.
Vsekakor koncentracija etanola, ki jo proizvaja fermentacija, ne presega 18%. Potrebno je koncentrirati raztopino etanola s pomočjo preproste destilacije. S to metodo dobimo raztopino etanola s koncentracijo okoli 95%.
Končno se uporablja frakcionirana destilacija in 95 -odstotna dehidracija alkohola za absolutno proizvodnjo alkohola. Etanol, ki ga proizvaja fermentacija, se uporablja v medicini in je rezerviran kot gorivo, ki dopolnjuje bencin.
Etilen hidracija
V tem procesu se etilen meša z visokimi temperaturami z deionizirano paro pri visokih temperaturah, med 250 in 300 ° C in pod tlakom 6.8 MPa. Pretvorba etilena v etanol katalizira s fosforno kislino, nameščeno na kopnem silicijev diato ali diatomi.
Vam lahko služi: mehanske lastnosti kovinReakcija hidratacije etilen lahko shematiziramo na naslednji način:
C2H4 + H2O → ch3Pogl2Oh
Del fosforne kisline vleče vodna para in ga je treba nevtralizirati z razredčenim natrijevim hidroksidom. Koncentracija etanola, pridobljene z etilen hidratacijo, je nizka, vrednost med 10 in 25%.
Nato etanol raztopino koncentriramo z destilacijo, pri čemer dobimo 95% raztopino etanola, ki jo lahko 100% izvedemo z delno destilacijo in dehidracijo.
Druge metode
Iz alternativnih metod za proizvodnjo etanola imamo uporabo ogljikovega dioksida, lipidov in celuloze. Uporaba celuloze je bolj obetavna, saj materiali, kot so les, slama, odpadni papirji itd., kot vir celuloze surovine. Celuloza je glukozni polimer in se lahko uporablja kot vir tega ogljikovega hidrata.
Strupenost in tveganja
 Domače alkoholne čolne običajno najdemo v 70%-90%koncentraciji
Domače alkoholne čolne običajno najdemo v 70%-90%koncentraciji Vdihavanje
Visoke koncentracije etanolne pare lahko povzročijo zaspanost, draženje oči in zgornji dihalni trakt, ki se kažejo s kašljem in glavobolom.
Neposreden stik s kožo in očmi
Kožni stik lahko povzroči suhost in kronično, draženje in dermatitis. Medtem očesni stik povzroča draženje, rdečico, bolečino in pekoč občutek.
Zaužitje
Ustvari pereč občutek in sprva ima spodbudno in prijetno delovanje zaradi proizvedene razkuževanja. Ko pa se vnos alkohola nadaljuje, je živčna depresija, glavobol, zamegljen vid, zaspanost in nezavest.
Kronični učinki
Etanol vpliva na centralni živčni sistem in zgornji dihalni trakt. Poleg tega lahko poškodba jeter, ki jo povzroča zaužitje etanola.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Etanol. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Etanol. Pubchem Comunund Povzetek za CID 702. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Zgodovina etanola. (2011). Zgodovina etanola - od alkohola do avtomobilskega goriva. Okrevano od: etanolhistory.com
- Uredniki Enyclopeedia Britannica. (2020). Etanol. Okrevano od: Britannica.com
- Corquiven. (15. oktober 2000). Varnostni list (MSDS) etilni alkohol. [PDF]. Okreval od: iio.In en.UABC.mx
- ByJU's. (2020). Uporaba metanola in etanola. Okreval od: byjus.com
- Čelada, Anne Marie, ph.D. (25. avgust 2020). Razlika med alkoholom in etanolom. Okreval od: Thoughtco.com

