Zapre
- 4894
- 1132
- Raymond Moen
Pojasnjujemo, kaj so alkani, njihove lastnosti, nomenklature, vrste in dajejo več primerov
Kaj so alkani?
The Zapre so najpreprostejše organske spojine, ki obstajajo. So nasičeni alifatski ogljikovodiki, ki jih tvorijo izključno ogljik in vodik, v katerih so ogljikovi združeni le s preprostimi preprostimi kovalentnimi vezmi.
Lahko so odprta veriga, v tem primeru imajo splošno formulo cnH2N+2. Prav tako lahko tvorijo enega ali več ciklov, v tem primeru pa splošna formula izgubi dva vodika za vsak oblikovan (cnH2N Če imajo en cikel, cnH2N-2 Če imajo 2 itd.).
Dosežemo veliko skupnih organskih spojin, ki jih uporabljamo vsak dan. Na primer, kuhinjski plin in zemeljski plin tvori en ali več plinastih alkanov. Gorivo za avtomobile (bencin, benzin ali gorivo, odvisno od države) je sestavljeno iz zapletenih mešanic tekočih alkanov, med katerimi so najpomembnejši izomeri oktana.
Alceanske lastnosti
So zelo malo reaktivne
Glavna kemična značilnost ali lastnost alkanov je, da gre za precej stabilne molekule, ki ne sodelujejo v kemijskih reakcijah, razen če so v zelo energijskih pogojih, kot so zelo visoke temperature ali v prisotnosti ultravijolične svetlobe ali prostih radikalov.
So apolarne spojine
Preproste povezave C-C in C so apolarna kovalentna vez, zato molekule alkanov ne morejo imeti neto dipolnega trenutka. Zaradi tega so apolarne molekule.
Imajo nizke vrele in fuzijske točke
Zaradi istega dejstva, da je apolarno, edine sile medmolekularne privlačnosti, ki so prisotne alkave, so sile disperzije, kot so sile van der Waalsa. Ker so te sile zelo šibke, jih je enostavno razbiti trdne snovi do tekočin in teh nizkih temperaturnih plinov.
So manj goste kot voda
Alkani so najmanj goste organske spojine in so vedno manj goste kot voda. Zaradi tega vedno lebdijo na površini vode, ko sta oba mešana.
Na splošno so brezbarvni
Plinasti in tekoči alkani so brezbarvni in prosojni. Ko pa so se strnili, tvorijo bele neprozorne amorfne trdne snovi, kot v primeru nekaterih parafinov in nekaj plastike.
Niso v vodi topni
Zlato pravilo za topnost je, da se podobno raztopi kot. Voda je polarno topilo, medtem ko so vsi alkani popolnoma apolarni, zato niso topni v vodi.
Vam lahko služi: diastreomeriV apolarnih organskih topilih so topni
Z istim prejšnjim argumentom so alkani topni v apolarnih topilih, kot sta benzen ali ciklohekan. Pravzaprav so tekoči alkani del apolarnih organskih topil.
Ne morejo trpeti dodajalnih reakcij
Ker so nasičeni ogljikovodiki, Alkani ne morejo trpeti dodajanja reakcij. Edina izjema je ciklopropan, ki ima obroč samo treh članov, ki se zelo napenja in ga je mogoče enostavno razbiti.
So goriva
Ena redkih kemičnih reakcij, v katerih sodelujejo alkani, je v zgorevanju in prav to je glavna uporaba.
Vrste alkanov
Alkani so lahko odvisno od povezljivosti med ogljikovimi atomi:
- Linearno
- Razvejano
- Ciklični (Cycloalcanos)
- Bicil ali policiklični
- Spirnos
Linearne alkane
So najpreprostejši od alkanov in zato od vseh organskih spojin. Vsi imajo molekularno formulo cnH2N+2 In zanje je značilno, da imajo eno samo verigo ogljikovih atomov, ki so med seboj povezane.
Ramificirani alkani
Imajo tudi splošno formulo cnH2N+2 Toda za razliko od linearnih alkanov je veriga ogljikovih atomov razvejana vsaj v enem trenutku. Raz razvejani alkani so verižni izomeri linearnih alkanov, saj se razlikujejo le v vrstnem redu, v katerem so atomi ogljika povezani.
Cycloalcanos
V cikloalkanosu se konci verige linearnih alkanov združijo in tvorijo ciklično verigo. Za oblikovanje te dodatne C-C vezi je treba odpraviti vodik iz vsakega terminalnega ogljika, tako da je splošna formula teh spojin CnH2N. Najmanjši možni cikel je od treh ogljikovih atomov, imenovanih ciklopropan (c3H6).
Tako kot alkani z odprtimi verigami, ki imajo lahko posledice, lahko tudi Cycloalcan predstavi nadomestne skupine v obliki odprtih verig.
Bicil in policiklične toke
Obstaja veliko cikličnih točk, v katerih imata dva ali več ciklov dva ali več ogljikovih atomov. Te spojine se imenujejo policija. Molekularna formula policije je odvisna od tega, koliko ciklov strukture.
V najpreprostejšem primeru kolesa je formula cnH2N-2 Ker je treba za zapiranje vsakega cikla izgubiti nekaj vodikov. Za policijo z več kot dvema združenimi cikli bo formula enaka formuli za alkane, manj kot par hidrogenov za vsak oblikovani cikel.
Vam lahko služi: HydraceSpirnos
Spiranials so poseben razred koles, v katerih imata oba cikla samo en atom ogljika. V teh primerih sta dva cikla v pravokotnih ravninah drug z drugim, zato je struktura videti, kot da je eden od ciklov zasukan glede na drugega.
Nomenklatura alkanov
Nomenklatura linearnih alkanov
Nomenklatura alkanov in pravzaprav v vseh organskih spojinah temelji na nomenklarici linearnih alkanov. Te so preprosto poimenovani glede na število ogljikovih atomov v verigi.
Prvi štirje prejmejo skupna imena, ki so metan, Ethan.) Do konca Alcana.
Število ogljikov | Molekularna formula | Sel -razvita formula | Ime |
1 | CH4 | CH4 | Metan |
2 | C2H6 | Ch3ch3 | Etano |
3 | C3H8 | Ch3ch2ch3 | Propan |
4 | C4H10 | CH3 (CH2) 2CH3 | Butan |
5 | C5H12 | CH3 (CH2) 3CH3 | Pentano |
6 | C6H14 | CH3 (CH2) 4CH3 | Heksan |
7 | C7H16 | Ch3 (ch2) 5ch3 | Heptano |
8 | C8H18 | CH3 (CH2) 6CH3 | Oktan |
9 | C9H20 | CH3 (CH2) 7CH3 | Nonano |
10 | C10H22 | CH3 (CH2) 8CH3 | Dekan |
Nomenklatura razvejanih alkal
Razrejeni alkani so poimenovani na imenu linearnih alkanov. Postopek vključuje izbiro ene od možnih ogljikovih verig, kot je glavna veriga in preostale posledice, ostajajo kot nadomestne skupine.
Postopek je sestavljen iz naslednjih korakov:
1. korak: Določite glavno verigo.
Izbor je izveden po naslednjih mestih v prednostni vrstnem redu:
- Izbrana je najdaljša veriga.
- Če jih je več, je iz njih izbranih največ posledic.
- V primeru več kot tistega, ki ima enako dolžino in enakega števila posledic, je tisto, ki pri oštevilčenju daje najmanjšo možno kombinacijo lokatorja.
- Če imata dve ali več verig enako dolžino, enako število posledic in vse imajo enake lokatorje, so izbrane tiste, ki dodelijo mladoletnike, ki se najprej pojavijo po abecednem vrstnem redu.
- V primeru, da je vse našteto enako, potem je mogoče izbrati vsakogar.
Glavna veriga daje glavno ime alkanu, kot da bi bil linearni alkan.
Lahko vam služi: kalijev nitrit (KNO2): struktura, lastnosti in uporabe2. korak: oštevilčite glavno verigo.
Ogljikovi atomi glavne verige v zaporedju od enega konca do drugega morajo biti navedeni po teh pravilih:
- Oštevilčenje, ki ga dodeli najnižja kombinacija lokatorjev za posledice.
- Če dve številki dajeta isto kombinacijo lokatorjev, je izbrana, ki jo lokatorji mladoletnikov dodelijo posledicam, ki se najprej pojavijo v abecednem vrstnem redu.
- V primeru, da sta oba enaka, potem ni pomembno, katera je izbrana.
3. korak: Poimenujte posledice in jih naročite po abecedi.
Posledice so poimenovane kot radikali, ki nadomeščajo _ano ustreznega linearnega alkana z _ilo koncem.
Število ogljikov | Radikalni alkil | Ime |
1 | -Ch3 | Radikalni metil |
2 | -Ch2ch3 | "Etil |
3 | -Ch2ch2ch3 | "Propy |
4 | -CH2 (CH2) 2CH3 | "Butil |
5 | -Ch2 (ch2) 3ch3 | "Pentilo |
6 | -CH2 (CH2) 4CH3 | "Hexilo |
7 | -Ch2 (ch2) 5ch3 | "Heptyl |
8 | -CH2 (CH2) 6CH3 | "Octilo |
9 | -Ch2 (ch2) 7ch3 | "NONAILO |
10 | -CH2 (CH2) 8CH3 | "Decil |
4. korak: Ime spojine je zgrajeno.
Ime je zgrajeno tako, da poimenuje vse posledice po abecednem vrstnem redu (zatiranje končne "o" najemnine), pred njim pa je sledil ime glavne verige.
Če se katera koli veja ponovi, se lokatorji vsakega postavijo, ločijo z vejicami in postavite predpono, ki označuje, kako se ponovi za 2, tri za 3 in tako naprej) pred vejo in tako naprej).
Primer:
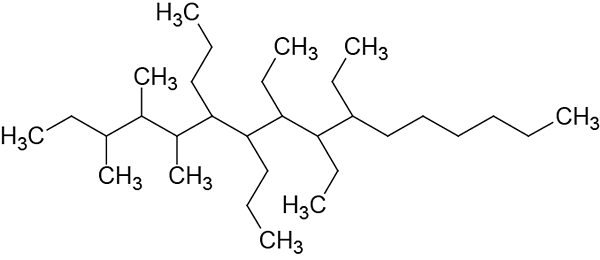
Poimenujte naslednje razvejane alkane:

1. korak: Izbira glavne verige.
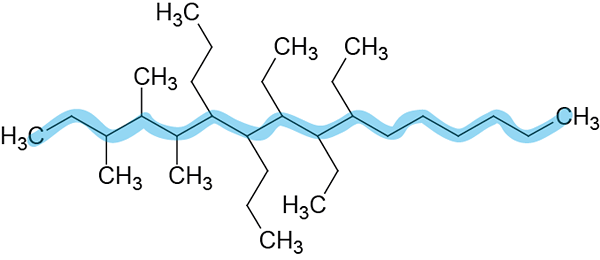
Ta veriga ima 16 ogljikov, zato bo poklicana glavna veriga Hexadecano.
2. korak: Oštevilčenje glavne verige.
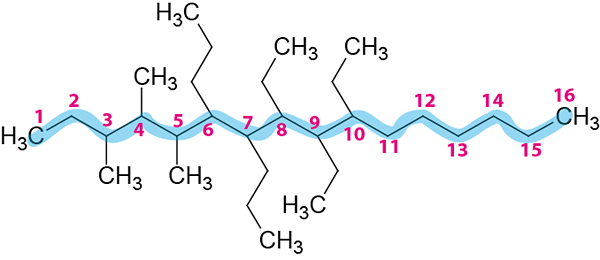
Oštevilčen je od leve proti desni, ker dajejo manjše lokatorje.
3. korak: Poimenujte vse posledice.
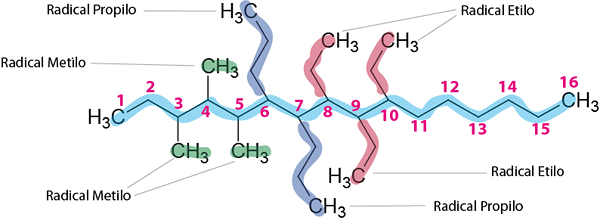
Obstajajo trije etilni radikali, trije metilni radikali in dva propilna radikala.
4. korak: Zgradite ime
Ime spojine bo:
8,9,10-trietil-3,4,5-trimetil-6,7-dipropilheksadekano
Primeri alkanov
V naslednji tabeli je predstavljeno nekaj dodatnih primerov alkanov.
Ime | Molekularna formula ali struktura | Radikalno | Število ogljikov |
Metan | CH4 | Metil | 1 |
Etano | C2H6 | Etil | 2 |
Propan | C3H8 | N-propil | 3 |
N-butan | C4H10 | N-Blight | 4 |
Isobutane | C4H10 | Isobutil | 4 |
N-pentane | C5H12 | N-pentile | 5 |
Isopentano | C5H12 | Izopentile | 5 |
Neopentano | C5H12 | Neopentilo | 5 |
N-heksan | C6H14 | N-heksil | 6 |
Polietilen | CH3 (CH2) NCH3 | ---- | > 100 |
Ciklopentano | C5H10 | Ciklopentil | 5 |
Cikloheksan | C6H12 | Cikloheksil | 5 |

