Koncept oksidacijskega sredstva, najmočnejši, primeri
- 2329
- 343
- Percy Feeney
A oksidacijsko sredstvo To je kemikalija, ki lahko odšteje elektrone iz druge snovi (reducirajoče sredstvo), ki jih podari ali izgubi. Znano je tudi kot oksidacijsko sredstvo v tem elementu ali spojini, ki prečka elektronegativne atome na drugo snov.
Ko se kemične reakcije preučijo, je treba upoštevati vse vpletene snovi in procese, ki se pojavijo. Med najpomembnejšimi so oksidno-redukcijske reakcije, imenovane tudi redoks, ki vključujejo prenos ali prenos elektronov med dvema ali več kemičnih vrstah.

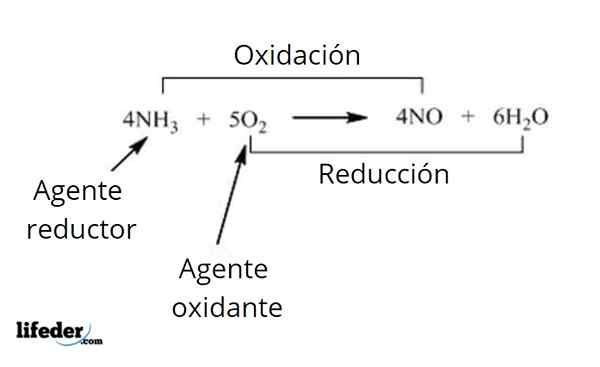
V teh reakcijah medsebojno delujeta dve snovi: redukcijsko sredstvo in oksidacijsko sredstvo. Nekatera oksidacijska sredstva, ki jih lahko pogosteje opazimo, so kisik, vodik, ozon, kalijev nitrat, natrijev perbat, peroksidi, halogeni in permanganat spojine.
Kisik velja za najpogostejše oksidacijska sredstva. Kot primer teh organskih reakcij, ki vključujejo prenos atomov, izstopa zgorevanje, ki je sestavljeno iz reakcije, ki nastane med kisikom in nekaterimi drugimi oksidacijskimi materiali.
[TOC]
Kaj so oksidacijska sredstva?
Pri oksidaciji se oksidacijsko sredstvo zmanjša, ker se ob prejemu elektronov iz reducirajočega sredstva zmanjša znižanje vrednosti obremenitve ali oksidacijskega števila enega od atomov oksidacijskega sredstva.
To je mogoče razložiti z naslednjo enačbo:
2mg (s) + o2(g) → 2mgo (s)
Vidimo, da magnezij (mg) reagira s kisikom (O2) in da je kisik oksidacijsko sredstvo, ker odšteje elektrone iz magnezija - to pomeni Reakcijsko reakcijsko sredstvo.
Lahko vam služi: kalkogeni ali amfumosPodobno je lahko reakcija med močnim oksidacijskim sredstvom in močnim reducirajočim sredstvom zelo nevarna, ker lahko nasilno komunicirajo, zato jih je treba shraniti na ločena mesta.
Kateri dejavniki opredeljujejo moč oksidacijskega sredstva?
Te vrste se odlikujejo glede na njihovo "moč". To pomeni, da so najšibkejši tisti, ki imajo manjšo sposobnost odštevanja elektronov iz drugih snovi,.
Namesto tega imajo najmočnejši večji enostavnost ali sposobnost, da "zažene" te elektrone. Za njihovo razlikovanje se upoštevajo naslednje lastnosti:
Atomski radio
Znana je kot polovica razdalje, ki loči jedra od dveh atomov od sosednjih kovinskih elementov ali "sosedov".
Atomske radijske sprejemnike so na splošno določene s silo, s katero je najbolj površinska elektrona privlačna za atomsko jedro.
Zato se atomski polmer elementa v periodični tabeli zmanjšuje od spodaj navzgor in od leve proti desni. To pomeni, da ima na primer litij bistveno večji atomski polmer kot fluorid.
Elektronegativnost
Elektronegativnost je opredeljena kot sposobnost atoma, da zajame elektrone, ki pripadajo kemični vezi sebi. Ko se elektronegativnost povečuje, imajo elementi naraščajoči trend za privabljanje elektronov.
Na splošno se elektronegativnost v periodični tabeli poveča z leve proti desni in se zmanjšuje, medtem ko kovinski značaj raste, fluor je najbolj elektronegativni element.
Elektronska afiniteta
Govori se, da je sprememba energije zabeležena, ko atom prejme elektron za ustvarjanje aniona; To pomeni, da je sposobnost snovi sprejeti enega ali več elektronov.
Vam lahko služi: aromatična elektrofilna substitucija: mehanizem in primeriKo se elektronska afiniteta povečuje, se oksidativna sposobnost kemične vrste poveča.
Ionizacijska energija
To je najmanjša količina energije, potrebne za zagon elektrona iz atoma ali, z drugimi besedami, merilo "sile", s katero je elektron povezan z atomom.
Večja je vrednost te energije, odvajanje elektrona je težji. Tako se ionizacijska energija poveča z leve desne in se v periodični tabeli zmanjša z vrha do dna. V tem primeru imajo plemeniti plini velike vrednosti ionizacije energije.
Najmočnejša oksidacijska sredstva
Če upoštevamo te parametre kemijskih elementov.
Kljub temu veljajo za najboljša oksidacijska sredstva, ki lahko oksidirajo veliko število snovi.
Primeri reakcij z oksidacijskimi sredstvi
V nekaterih reakcijah redukcije oksida je lažje vizualizirati prenos elektronov kot pri drugih. Nekateri najbolj reprezentativni primeri bodo razloženi spodaj:
Primer 1
Reakcija razgradnje živega oksida:
2HGO (S) → 2HG (L) + O2(g)
V tej reakciji se živo srebro (oksidacijsko sredstvo) loči kot sprejemnik kisika (reducirsko sredstvo), ki se razgradi v tekoče živo srebro in plin kisik pri segrevanju.
Lahko vam služi: láurinska kislina: struktura, lastnosti, uporabe, koristi, učinkiPrimer 2
Druga reakcija, ki ponazarja oksidacijo, je žveplova gorenja v prisotnosti kisika, da tvori žveplov dioksid:
S (s) + o2(g) → Torej2(g)
Tu je razvidno, da je molekula kisika oksidirana (reducirajoče sredstvo), medtem ko se osnovni žveplo zmanjša (oksidacijsko sredstvo).
Primer 3
Končno reakcija zgorevanja propana (ki se uporablja v plinu za ogrevanje in kuhinjo):
C3H8(g) + 5o2(g) → 3CO2(g) + 2h2Ali (l)
V tej formuli lahko opazimo zmanjšanje kisika (oksidacijsko sredstvo).
Reference
- Sredstvo za zmanjšanje. Pridobljeno iz.Wikipedija.org
- Chang, R. (2007). Kemija, deveto izdajo (McGraw-Hill).
- Malone, l. J., In Dolter, t. (2008). Osnovni koncepti kemije. Okrevano iz knjig.Google.co.pojdi
- Ebbing, d., In Gammon, s. D. (2010). Splošna kemija, izboljšana izdaja. Okrevano iz knjig.Google.co.pojdi
- Kotz, J., Treichel, str., In towsend, j. (2009). Kemija in kemična reaktivnost, izboljšana izdaja. Okrevano iz knjig.Google.co.pojdi
- « Značilnosti visoke gore, vreme, favna, flora, lokacija
- Značilnosti mezopotamskih umetnin, slikarstvo, skulptura, keramika »

