Natrijeva acetatna struktura, lastnosti, sinteza, uporablja

- 4479
- 48
- Dexter Koch
On natrijev acetat To je natrijeva sol ocetne kisline, katere molekularna formula je c2H3Tudi2Na. Sestavljen je iz belega prahu, ki je v bistvu prisoten v dveh oblikah: brezvodni in trihidrat. Oba sta zelo topna v vodi, univerzalno topilo; Vendar ne tako topno v alkoholih ali acetonu.
Oblika anhidra ima gostoto, fuzijo in vrelišče z višjimi vrednostmi kot tista, ki jo predstavlja trihidratna oblika natrijevega acetata. To je zato, ker molekule vode posegajo med interakcije Na ionov+ in pogl3COO-.
 Videz natrijevega acetata
Videz natrijevega acetata Natrijev acetat je stabilen, še posebej, če je shranjen med 2 in 8 ° C; Vendar je dovzetna za delovanje močnih oksidacijskih sredstev in halogenov.
Pripravimo ga lahko z reakcijo natrijevega bikarbonata z ocetno kislino. Tudi z reakcijo ocetne kisline z natrijevim hidroksidom. Obe reakciji sta preprosti za izpopolnjene in nizke gospodarske stroške; Prvo je mogoče celo narediti doma.
Ta sol je malo strupena spojina. Povzroči draženje kože, šele po pogostih in neprekinjenih stikih. Za oči je malo razdražljivo, vendar lahko draži dihalne poti. Ni podatkov o škodljivem učinku vašega zaužitja.
Ima številne uporabe in aplikacije, ki poudarja njegovo funkcijo dušenja pH, skupaj z ocetno kislino. Acetatni amortiber ima PKA = 4,7; ki daje visoko učinkovitost pri regulaciji pH v kislem okolju z vrednostmi pH med 3 in 6.
Zaradi nizke strupenosti in lastnosti se je pogosto uporabljala za izboljšanje okusa hrane, pa tudi agent, ki zagotavlja zaščito pred njihovim razpadom zaradi njihovega delovanja proti mikrobom.
[TOC]
Natrijeva acetatna struktura
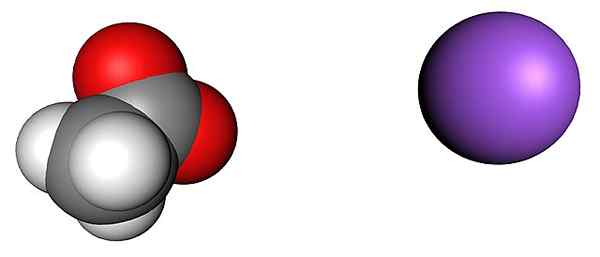 Acetatni in natrijevi ioni. Vir: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Acetatni in natrijevi ioni. Vir: SHU0309 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Zgornja slika prikazuje ione, ki sestavljajo brezvodni kristali natrijevega acetata (brez vode). Vijolična krogla ustreza na kationu+, In molekularni ion na levi strani je acetat, cho3COO-, S svojimi kisikovimi atomi, ki jih predstavljajo rdeče sfere.
Ti vrstniki, v skladu s čipom3Pot, so v deležu 1: 1; Za vsak Cho3COO-, Obstajati mora nado kation+ privlačen zaradi negativne obremenitve in obratno. Tako znamenitosti med njimi in odbojnosti med enakimi obremenitvami na koncu vzpostavijo strukturne vzorce, ki definirajo kristal, katerih minimalna ekspresija je enotna celica.
Ta enotna celica, tako kot celota kozarec, se razlikuje glede na razporeditev ionov v vesolju; Ni vedno enako, tudi za isti kristalni sistem. Na primer, brezvodni natrijev acetat lahko tvori dva ortorrambična polimorfa, od katerih je eden predstavljen spodaj:
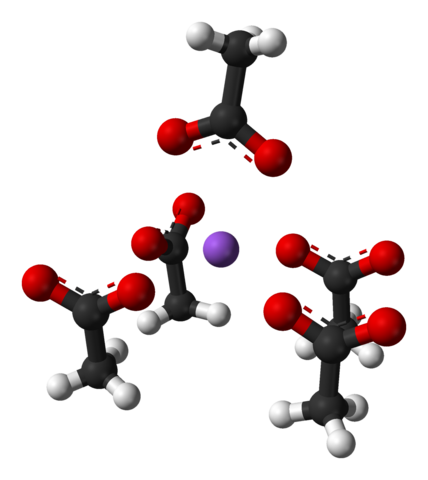 Enotna celica natrijevega acetata ortorambovo kristali. Vir: Benjah-BMM27 [javna domena]
Enotna celica natrijevega acetata ortorambovo kristali. Vir: Benjah-BMM27 [javna domena] Upoštevajte razporeditev ionov: štiri izbire3COO- Priložijo na+ na tak način, da "narišejo" izkrivljeno kvadratno osnovno piramido. Vsak od teh CHO3COO- posledično interakcijo z drugim NA+ v bližini.
Hidrirani kristali
Natrijev acetat ima veliko afinitete do vode; Pravzaprav je okusna, to pomeni, da zadrži vlago, dokler se ne raztopi v istem. Večja je vlaga, prej se "stopi". To je zato, ker tako3COO- Kot Na+ Lahko hidrirajo, se obkrožajo z molekulami vode, ki usmerjajo svoje dipole do svojih obremenitev (NA+ Oh2, Pogl3COO- Hoh).
Vam lahko služi: Silver Bromid (AGBR): Struktura, lastnosti in uporabeKo se ta sol pripravi v laboratoriju ali doma, je takšna afiniteta do vode, da se tudi pri normalnih temperaturah že dobi kot hidrata; pogl3Pata · 3h2Tudi. Njihovi kristali prenehajo biti ortorrambični in postanejo monoklinični, saj zdaj vključujejo tri molekule vode za vsak par Cho3COO- in na+.
Lastnosti
Imena
-Natrijev acetat.
-Natrijev etanoat (IUPAC).
Molarna masa
-Brezvodna: 82,03 g/mol.
-Trihidrirano: 136,03 g/mol.
Vidik
Delicuescent Beli prah.
Vonj
Kis, ko se segreje na razgradnjo.
Gostota
-Anhidro: 1, 528 g/cm3 pri 20 ° C.
-Trihidrirano: 1,45 g/cm3 pri 20 ° C.
Tališče
-Anhidro: 324 ° C (615 ° F, 597 K).
-Triohidrat: 58 ° C (136 ° F, 331 K).
Vrelišče
-Anhidro: 881,4 ° C (1.618,5 ° F, 1.154,5 K).
-Trihidrat: 122 ° C (252 ° F, 395 K). Razpade.
Topnost
V vodi
-Anhidro: 123,3 g/100 ml pri 20 ° C.
-Trihidrirano: 46,4 g/100 ml pri 20 ° C.
V metanolu
16 g/100 g pri 15 ° C.
V etanolu
5,3 g/100 ml (trihidrat).
V acetonu
0,5 g/kg pri 15 ° C.
Kislost
PKA: 24 (20 ° C).
Basicy
PKB: 9.25. Tu je očitno, da je natrijev acetat osnovna sol, da mora imeti PKB manj kot njegov PKA.
Indeks loma (ηD)
1.464
Kalorična zmogljivost
-100,83 j/mol · k (brezvodni).
-229,9 J/mol · K (Trihidrado).
točka vžiga
Več kot 250 ° C.
Temperatura samoificiranja
600 ° C.
ph
8,9 (raztopina 0,1 m do 25 ° C).
Stabilnost
Stabilno. Nezdružljivo z močnimi in halogenskimi oksidacijskimi sredstvi. Vlaga.
Reakcije
Natrijev acetat lahko tvori ester tako, da reagira z najemom halogenida; Na primer, Bromoetano:
Pogl3Poron +BRCH2Pogl3 => Ch3Cooch2Pogl3 + NABR
Natrijev acetat je dekarboksila, da tvori metan (piroliza) v prisotnosti NaOH:
Pogl3Poon +naoh => ch4 + Na2Co3
Reakcijo katalizira s prodajo Cesio.
Sinteza
Natrijev acetat lahko v laboratoriju proizvajamo z nizkimi stroški z reakcijo natrijevega bikarbonata z ocetno kislino:
Nahco3 + Pogl3Cooh => ch3Pot +h2Co3
To reakcijo spremlja prisotnost v raztopini intenzivnega mehurčka zaradi razpada ogljikove kisline v vodi in ogljikovem dioksidu.
H2Co3 => H2Ali +co2
Industrijsko se natrijev acetat proizvaja z reakcijo ocetne kisline z natrijevim hidroksidom.
Pogl3COOH +NAOH => CH3Pot +h2Tudi
Prijave
Toplotne vrečke
Natrijev acetat se uporablja za proizvodnjo toplotnih vrečk.
Sprva se solni kristali raztopijo v volumnu vode za pripravo raztopine, ki postane prenasičena.
Nato se segreva raztopina pri temperaturi, večji od 58 ° C. Nadzorovane raztopine pri sobni temperaturi se pusti, da se ohladi in tvorbe kristalov ne opazimo; Rešitev je prekomerna -čir.
Vam lahko služi: periodična tabela, za kaj je namenjenaOdsotnost kristalov je razložena, da so molekule tekočine preveč zmedene in nimajo dolžnih napotkov za doseganje temperature kristalizacije. Tekočina je v metastabilnem stanju, stanje neravnovesja.
Daj. V primeru toplotnih vrečk pritisnemo mehansko pritrditev, da mešamo tekočino in sprožimo tvorbo kristalov in strjevanje trihidrirane raztopine natrijevega acetata.
Ko pride do kristalizacije, se temperatura povečuje. Trihidrirani kristali natrijevega acetata pridobijo videz ledu, vendar so vroče, zato se imenuje "vroč led".
Industrijalisti
-Natrijev acetat se v tekstilni industriji uporablja kot mordant v procesu obarvanja tkiv
-Nevtralizirajte odpadke z žveplovo kislino
-Pri predelavi bombaža se uporablja za izdelavo bombažnih blazinic, uporabnih pri osebnem čiščenju in za medicinske namene
-Uporablja se v kovinskih kisečih, pred kromom
-Sodeluje tako, da se v procesu proizvodnje sintetične gume ne pojavi vulkanizacija kloroprena
-Posega v čiščenje glukoze
-Uporablja se v kožicah.
Medicinska uporaba
Natrijev acetat je del spojin, ki se uporabljajo za oskrbo z elektroliti, ki se dajejo bolnikom intravensko.
Uporablja se za odpravljanje ravni natrija pri hiponatemičnih bolnikih, tudi pri popravku presnovne acidoze in alkalinacije z urinom.
Raztopina za dušenje pH
Uporablja se kot regulator pH v številnih encimskih reakcijah, ki se pojavijo med pH 3 in pH 6.
Različni pH raztopine acetata se dosežemo s spreminjanjem koncentracije ocetne kisline in natrijevega acetata.
Na primer, da dobimo pH 4,5, ima puferska raztopina koncentracija ocetne kisline 3,8 g/L in koncentracijo brezvodnega natrijevega acetata 3,0 g/L.
Koncentracija raztopine acetatnega pufra se lahko poveča in v enakem deležu poveča sestavne dele potrebne raztopine za pridobitev želenega pH.
Absorber za acetat/acetonitril se uporablja pri kapilarni elektroforezi pri ločitvi fotoberberina.
Raziskovalni laboratoriji
-Natrijev acetat je šibko nukleofilno sredstvo, ki se uporablja pri anionski polimerizaciji β-laktona.
-Uporablja se kot reagent v jedrski magnetni resonanci bioloških makromolekul.
-Uporablja se pri ekstrakciji celic celic. Natrij je kation, ki deluje z negativnimi obremenitvami fosfatov, ki so prisotni v DNK, kar pomaga pri kondenzaciji. V prisotnosti etanola DNK tvori oborino, ki jo lahko nato ločimo v vodno plast.
Ohranjanje hrane
-Pomaga preprečiti rast bakterij, poleg tega, da prepreči nastajanje odvečne kislosti, ki povzroča poslabšanje hrane, s čimer ohranja določen pH.
-Natrij, ki je prisoten v acetatu, izboljša okus hrane.
-Natrijev acetat se uporablja pri pripravi zelenjavnih kumaric: kumare, korenčka, čebule itd. Poleg tega se uporablja pri ohranjanju mesa.
Vam lahko služi: dimetilanil: struktura, lastnosti, sinteza, uporabaOhranitev betona
Beton je poškodovan z delovanjem vode, ki skrajša njegovo trajanje. Natrijev acetat deluje kot betonsko sredstvo za tesnjenje, ki ga vodoodporen v vodo, kar podaljša njegove začetne značilnosti.
Mladi poskusi
Eksperiment 1
Preprost eksperiment je sinteza natrijevega acetata skozi reakcijo natrijevega bikarbonata s kisom (5%ocetna kislina).
30 ml kisa je nameščenih v čašo in dodamo približno 3,5 g bikarbonata.
V reakcijskih natriju in ogljikovih kislinah nastane. Kislina se razgradi na ogljikov dioksid in vodo. Generacija ogljikovega dioksida bo v raztopini ustvarila intenziven mehurček.
Za zbiranje natrijevega acetata se povzroči izhlapevanje vode in segrevanje raztopine.
Eksperiment 2
Drug preprost eksperiment je tvorba natrijevega trihidrata acetata.
Če želite to narediti, približno 20 g natrijevega acetata trihidrata in postavite v čašo, nato pa dodate 10 ml vode, nato pa dodate 10 ml vode. Raztopina segreva na temperaturo, večjo od 58 ° C.
Natrijev acetat je popolnoma raztopljen, da se zagotovi, da je raztopina prenasičena. Prej je na hladni površini nameščena kapsula Pietri.
Vsebnost čaše s trihidratnim acetatom v Pietrijevi kapsuli počasi vliva. Temperatura tekočine v kapsuli se začne spuščati, tudi pod tališčem, ne da bi opazili kristalizacijo ali strjevanje natrijevega acetata.
Običajno za nastanek kristalizacije trihidriranega natrijevega acetata dodamo majhno količino soli, ki služi kot jedro kristalizacije. Drugič je majhna motnja raztopine, da sproži kristalizacijo natrijevega acetata.
Trihidrirani kristali natrijevega acetata so videti kot led, če pa se jih dotaknemo. Zaradi tega se sol imenuje "vroč led".
Strupenost
Natrijev acetat je zelo malo strupene spojine. Prav tako ga ni razvrščen kot senzibilizator za kožo in dihalne poti.
Poleg tega natrijev acetat ni razvrščen kot mutageno sredstvo v zarodnih, rakotvornih ali strupenih celicah za razmnoževanje.
Skratka, za oči je malo razdražljivo. Dihalne poti se lahko po vdihavanju dražijo. Pogost in stalen stik s kožo lahko povzroči draženje.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Worldofchemicals. (16. januar 2017). Kako pripraviti natrijev acetat doma? Okrevano od: medij.com
- Nacionalni center za informacije o biotehnologiji. (2019). Natrijev acetat. Baza podatkov Pubchem. Cid = 517045. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- S. Cameron, k. M. Mannan in m. Tudi. Rahman. (1976). Kristalna struktura natrijevega acetata trihidrata. Krist dejanje. B32, 87.
- Wikipedija. (2019). Natrijev acetat. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (24. januar 2019). Naredite vroč led iz kisa in sode bikarbone. Okreval od: Thoughtco.com
- Kemijska knjiga. (2017). Natrijev acetat. Obnovi se od: Kemicalbook.com
- Wasserman Robin. (2019). Uporaba natrijevega acetata. Okrevano od: Livestrong.com
- Droge. (2019). Natrijev acetat. Okrevano od: drogebank.AC

