Amonijeva acetatna struktura, lastnosti, uporabe in tveganja

- 3644
- 791
- Dexter Koch
On Amonijev acetat To je anorganska sol, katere kemična formula je NH4Pogl3COOH. Izhaja iz mešanice ocetne kisline, ki je prisotna v komercialnem kisu do 5 -odstotne koncentracije, in amoniaka. Obe začetni snovi imata značilne vonjave, zato je mogoče dobiti predstavo, zakaj ta sol diši po kis-amoniji.
Vendar najbolj vrhunec te soli ni njen vonj, ampak njegova nizka tališče. Tako nizka je, da ga je v katerem koli laboratoriju mogoče dobiti v svoji tekoči različici, kjer ioni prosto tečejo za prevoz električnih obremenitev.
 Kristali amonijevega acetata. Vir: Vidak [javna domena].
Kristali amonijevega acetata. Vir: Vidak [javna domena]. Po drugi strani je amonijev acetat okusen; to pomeni, da absorbirajo vodo ali vlažnost okolja, dokler se popolnoma ne raztopi. Zato so, čeprav so v brezvodu, njihovi kristali beli, hitro postanejo svetli (kot tisti v čaši zgornje slike).
Ker je trden vir amoniaka, ga je treba manipulirati tako, da je vdihavanje njegovih hlapov zmanjšano. Toda kljub tej negativni značilnosti NH4Pogl3COOH je uporaben za pripravo varovalnih raztopin, ki jih hrani obdrži, medtem ko je sestavni del nekaterih ekstraktorjev beljakovin topila.
[TOC]
Struktura amonijevega acetata
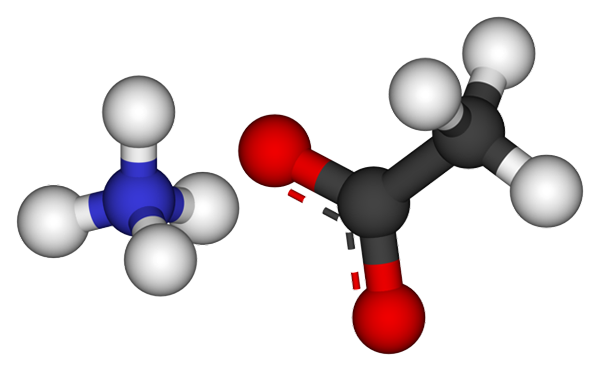 Amonijevi acetatni ioni. Vir: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Amonijevi acetatni ioni. Vir: CCOIL [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] Zgornja slika prikazuje ione, ki sestavljajo amonijev acetat v modelu sfere in palic. Na levi je tetraedrska geometrijska kation, NH4+, Medtem ko je na desni strani molekulski anion z dvema demokiranimi elektroni med dvema atoma kisika, CH3COO- (Pikčasta črta med rdečimi sferami).
Tako oba iona, NH4+ in pogl3COO-, Ostanejo združeni z njihovo elektrostatično privlačnostjo, ki skupaj z odbojnostmi med enakimi obremenitvami na koncu določi kristal. Ta amonijev acetatni kristal ima ortrorombično strukturo, ki jo je mogoče opaziti v mikroskopskih vzorcih ali celo vidnih velikostih.
Vam lahko služi: ionska povezava: značilnosti, kako se oblikuje, in primeriNe samo, da je ionska vez za to soljo pomembna, ampak tudi vodikovi mostovi. NH4+ Lahko podarite do štiri od teh mostov; To pomeni, da je v vsakem od tozov svojega tetraedna atom kisika iz CHO3COO- sosed (h3N+-H-oh3).
Teoretično bi morale biti sile znotraj njihovih kristalov zelo močne; Toda eksperimentalno se zgodi nasprotno, saj se topi le 114 ° C. Zato vodikovi mostovi ne kompenzirajo šibkosti njihove ionske vezi niti nizke retikularne energije NH ortrorrhromskega stekla4Pogl3COO.
Druge skladbe in voda
Na začetku je bilo rečeno, da se amonijev acetat pripravi z mešanjem ocetnega in amoniaka. Zato se sol lahko izrazi tudi kot: NH3Pogl3COOH. Tako je mogoče dobiti druge strukture, odvisno od sestave: NH3· 2ch3Cooh, o nh3· 5CH3COOH, na primer.
Omenjeno je bilo tudi, da absorbira dovolj vlage. Pri tem vključuje molekule vode v svoje kristale, ki hidrolizirajo NH3 ali pogl3COOH; In zato sol oddaja vonj amoniaka ali kisa.
Lastnosti
Fizični videz
Delicuescent Beli kristali z vonjem po kisu in amoniaku.
Molarna masa
77.083 g/mol.
Gostota
1.073 g/ml pri 25 ° C.
Tališče
114 ° C. Ta vrednost je v primerjavi z drugimi soli ali ionskimi spojinami znatno nižja. Poleg tega nima vrelišča zaradi nastajanja amoniaka, kar pomeni razgradnjo soli.
Topnost
143 g/100 ml pri 20 ° C. Upoštevajte svojo izjemno topnost vode, ki prikazuje afiniteto, ki jo občutijo molekule vode na ionih NH4+ in pogl3COO-, Ki jih je v vodni sferi.
Vam lahko služi: pravila Hume-rotheryNjegova topnost ni takšna v manj polarnih topilih. Na primer, v 100 ml metanola pri 15 ° C 7,89 g NH4Pogl3COO.
Stabilnost
Je okusno, zato se izogibajte shranjevanju v mokrih prostorih. Tudi, medtem ko absorbira vodo, osvobodi amoniak in se zato razgradi.
PKA
9.9.
Ta konstanta ustreza kislosti amonijevega iona:
Nh4+ + B nh3 + Hb
Kjer je HB šibka kislina. Če je baza B voda, bo reakcija hidrolize reakcija:
Nh4+ + H2Ali nh3 + H3Tudi+
V kateri vrstah h3Tudi+ Določite pH raztopine.
Po drugi strani pa acetat prispeva tudi k PH:
Pogl3COO- + H2Ali pogl3COOH + OH-
Tako obe vrsti h3Tudi+ in oh- Nevtralizirajo jih tako, da dajo pH 7, nevtralni. Vendar pa imajo po Pubchemu visoko koncentrirane raztopine amonijevega acetata kisli pH; kar pomeni, da prevladuje hidroliza NH4+ O izbiri3COO-.
Standardna entalpija treninga
ΔFH298 = -615 kJ/mol.
Prijave
Analitično
Vodne raztopine natrijevega acetata omogočajo solubilizacijo svinca, železov in cinkovih sulfatov, da naknadno določijo njihovo koncentracijo z atomsko absorpcijsko spektroskopijo.
Napol voznik
Kot nizkotemperaturne obroke v primerjavi z drugimi soli lahko njeno tekočino uporabljamo za pogon električnega toka, ki se vklopi na vezje žarnice.
Pufer
Spremembe pH lahko uredite v kislih ali osnovnih intervalih, ki se uporablja za vzdrževanje stalnega pH v, na primer meso, čokolade, sire, zelenjava ali druge prehrambene izdelke.
Vam lahko služi: molybdenNa ledu in tleh
Gre za biološko razgradljivo in relativno poceni sol, ki se uporablja za odmrzovanje ledenih poti. Tudi zato, ker je vir vodnega topnega dušika, je namenjen kmetijski uporabi za določitev ravni kalija.
Oborilni agent
Ta sol se uporablja za oborino beljakovin za izvajanje kromatografske analize.
Zdravilo
Amonijev acetat deluje kot veterinarsko diuretično sredstvo, poleg tega pa je potrebna sol za sintezo insulina in penicilina.
Tveganja
Naslednja in končno nekaj negativnih tveganj ali posledic, ki jih povzroča amonijev acetat, so navedeni:
- Na koži lahko povzroči rahla draženja, vendar brez absorpcije v njej.
- Ko zaužijemo vzrok želodec, drisko, diurezo, tesnobo, večjo potrebo po uriniranju, tresenjem in drugimi simptomi, povezanimi z zastrupitvijo.
- Njegovo inhalacijo draži nos, grlo in pljuča.
Ostalega ni znano, ali lahko rak ustvari, in morebitno tveganje za požar zaradi te soli zavržemo (vsaj v normalnih pogojih skladiščenja).
Reference
- Inger Nahringbauer. (1967). Študije vodikove vezi. Xiv. Kristalna struktura amonijevega acetata. Inštitut za kemijo, Univerza v Uppsali, Uppsala, Švedska. Krist dejanje. 23, 956.
- Nacionalni center za informacije o biotehnologiji. (2019). Amonijev acetat. Baza podatkov Pubchem. Cid = 517165. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Sullivan Randy. (2012). Prevodnost amonijevega acetata. Okreval od: Chemdemos.Uoregon.Edu
- Viachem, Ltd. (s.F.). Amonijev acetat. Okreval od: Viacheminc.com
- Wikipedija. (2019). Amonijev acetat. Pridobljeno iz: v.Wikipedija.org
- Ministrstvo za zdravje v New Jerseyju. (2012). Amonijev acetat: informativni list o nevarnih snovi. [PDF]. Okreval od: NJ.Gov
- Xueyanghu. (s.F.). Uporaba in tveganja amonijevega acetata. Okreval od: xueyanghu.WordPress.com
- « Značilnosti alizarina, priprave, uporabe in strupenosti
- Struktura, lastnosti in uporabe železnega hidroksida (III) »

